华大时空组学技术Stereo-seq是一项基于DNA纳米球测序芯片自主研发、可实现超高通量和超高精度的全景式时空转录组技术,它将认识生命空间的分辨率提升至500 nm的亚细胞层级,相比国际同类技术分辨率提升了40,000倍。Stereo-seq目前已被成功应用到动物胚胎发育、植物研究、脑科学、肿瘤等多个领域,并助力研究人员在Cell、Science、Nature、Cell Research等期刊上发表了50余篇文章。
近日,华大时空组学STOmics与美吉生物达成合作,美吉生物正式成为华大时空组学STOmics生态合作伙伴 。美吉生物在单细胞组学、微生物组学、基因组学、转录调控组学、蛋白组学、代谢组学、(高分辨)空间组学等方向积累了丰富经验,致力于通过一站式组学无忧解决方案,加速客户科研进程和成果产出。
此次美吉生物全面引进华大时空组学技术,将为研究人员提供更高精度的空转检测服务,助力广大科研工作者在生命结构、疾病机制、生长发育机制等研究领域获得新的认知。
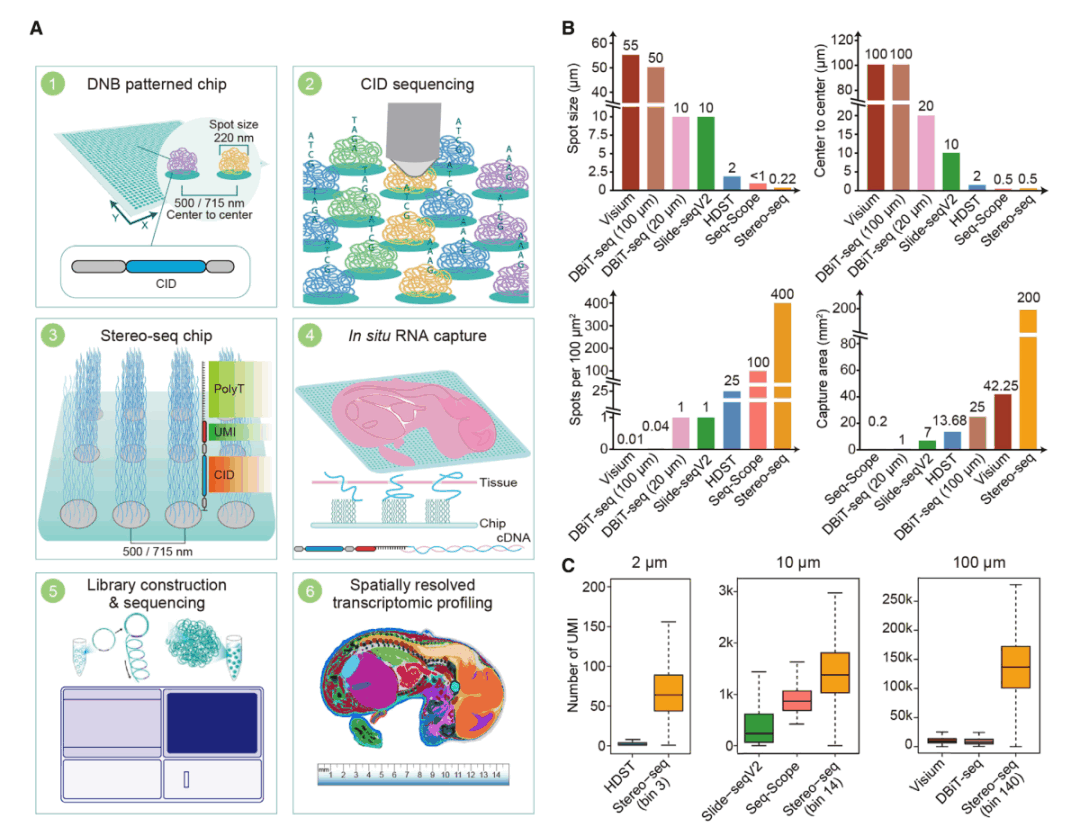
01 纳米级分辨率,实现亚细胞级分子定位
Stereo-seq能实现对单个细胞及分子信息进行空间定位和检测,其核心在于自主研发的用于mRNA定位的时空芯片。该芯片由布满了数亿至数百亿规则阵列排布的单链线球状DNA纳米球组成,每个DNB直径为220 nm,两个DNB中心点间距范围为500 nm。
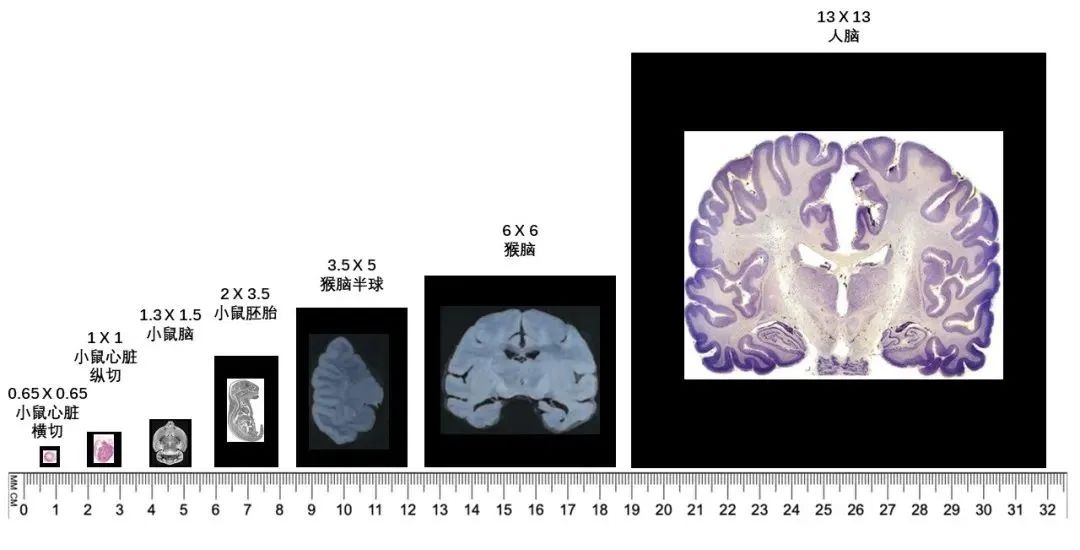
02 厘米级全景视场,检测组织大小可定制
Stereo-seq设计的常规芯片大小为1 cm×1 cm,同时可依据组织大小定制不同尺寸的芯片。华大时空组学现已推出时空芯片S0.5,该芯片尺寸为0.5 cm×0.5 cm,可灵活兼容现有技术流程 ,极大地提升芯片利用率,同时依旧可以实现高水平的细胞分割。未来,华大时空组学还将根据实际科研需求推出大尺寸芯片。
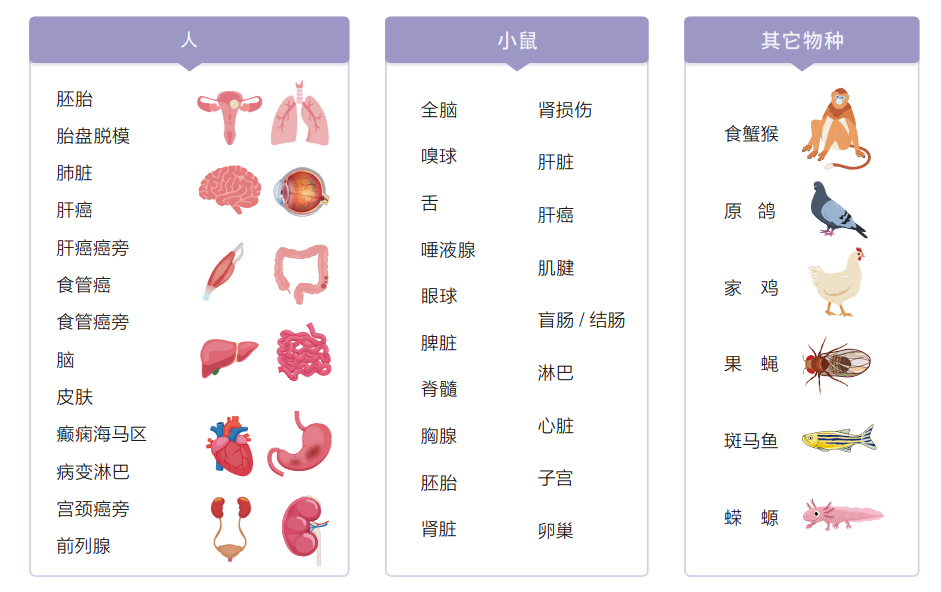
03 物种组织不设限,人、动物及植物多覆盖
Stereo-seq技术目前已研发了针对人、不同动物及植物的各部位组织器官的检测方法,完成了多种动植物的组织器官研究。
04 全转录组及100+重蛋白原位共检测
除了时空转录组,为了帮助科研人员通过多组学研究更深入地探索疾病的发生发展机制,华大时空组学开发了时空蛋白转录组Stereo-CITE,该技术可以在同一张组织切片上、以单细胞/亚细胞级分辨率、实现全转录组和100+重蛋白的原位共检测,并配有强大的分析工具,生成基因和蛋白的空间表达图谱。
关于美吉生物
上海美吉生物医药科技有限公司(以下简称美吉生物)成立于2009年,坐落于上海浦东新区国际医学园区,在北京、广州、武汉、重庆、成都等地均设有驻地办事处。
美吉生物是国家级专精特新“小巨人”企业,多次荣获上海市服务型制造示范平台、企业博士后工作站、上海市科技小巨人培育企业、上海专利工作试点企业、上海品牌培育示范企业、上海品牌明日之星、浦东企业研发机构称号;拥有CNAS、ISO 9001、ISO 14001、ISO 45001、AAA等重量级荣誉认证;拥有自主知识产权235项,国家发明专利51项,承担各级科研项目20多项。
美吉生物深耕科研服务15年,专业提供单细胞组学、微生物组学、基因组学、转录调控组学、蛋白组学、代谢组学、(高分辨)空间组学等多组学技术服务,自主开发美吉生物云平台,通过整合基因测序大数据、生物信息算法、互联网交互技术,为广大科研工作者提供一站式组学无忧解决方案服务。美吉生物致力于通过一站式组学无忧解决方案,加速客户科研进程和成果产出,目前已与5000余家单位建立合作。
仅2023年,在美吉生物一站式组学无忧解决方案的助力下,美吉生物合作伙伴发表文章数高达3269篇,影响因子已高达26102.2分,平均文章影响因子8.0分。其中,10分以上的文章822篇,8分以上的文章1447篇。
关于华大时空
华大作为时空组学领域的重要推动者,在2020年发布了自主研发的时空组学技术Stereo-seq,华大时空组学STOmics应运而生,助力生老病死、意识起源、万物生长、生命起源等重大科学问题的研究与应用。
2022年,凭借能同时实现“纳米级分辨率”和“厘米级全景视场”的技术优势,Stereo-seq助力研究人员陆续在Cell Nature Science
秉承华大集团“基因科技造福人类”的使命,华大时空组学STOmics将积极推进全球科研合作,同时致力于促进时空组学技术的产业化应用,为科研和临床领域带来新的认知及价值。
参考文献:
Chen A, Liao S, Cheng M, et al. Spatiotemporal transcriptomic atlas of mouse organogenesis using DNA nanoball-patterned arrays[J].Cell, 2022,185(10):1777-1792.e21. doi:10.1016/j.cell.2022.04.003.