中国科学院动物研究所、北京大学生命科学学院和深圳华大生命科学研究院的研究人员利用单细胞RNA测序(scRNA-seq)和空间转录组(包括华大自主研发的时空组学技术Stereo-seq)联合分析,绘制了小鼠胎肝(fetalliver,FL)发育的单细胞时空转录组图谱,解析了造血干/祖细胞的转录组和功能异质性,鉴定了新型的造血干细胞扩增的功能单元(HSC'pocket-like' units, HSC PLUS)并揭示了其分子机制。该文章在2021年8月发表于Cell Research,下面是详细解读。

文章题目:Identification of HSC/MPP expansion units in fetal liver by single-cell spatiotemporal transcriptomics
发表时间:2021-08-02
发表期刊:Cell Research
主要研究团队:中国科学院动物研究所、北京大学团队和深圳华大生命科学研究院
影响因子:25.617
DOI:10.1038/s41422-021-00540-7
研究背景
在哺乳动物中,造血干细胞和多能祖细胞(hematopoietic stem cell and multipotent progenitor,HSC/MPP)占据着造血系统层次的顶端,表现出多向分化和自我更新的能力。HSC/MPP扩增的研究在再生医学中具有很好的应用前景。目前可以通过基因操作或优化培养条件来实现长期的HSC/MPP体外扩增。而在HSC/MPP体外扩增培养中,关键的挑战是如何保持干细胞的特性,因此,需要全面地了解HSC/MPP在体内原生生态位中的扩增。高度血管化的FL是各种来源的造血细胞(hematopoietic cells,HCs)的暂时发育场所。越来越多的证据表明,在小鼠中,FL结构的niche细胞(包括内皮细胞、基质细胞和肝母细胞)通过不同的生长因子、细胞因子和趋化因子与HSCs/MPP相互作用。解析这一扩增性造血器官将为体外扩增造血干细胞提供理论指导,因此,需要全面了解HSC/MPP与不同的niche细胞之间相互作用的复杂机制,以及HSC/MPP扩增的系统调控网络。
研究样本
雄性CD45.1小鼠与雌性CD45.2小鼠杂交获得的CD45.1/.2小鼠胚胎;选择终止妊娠后获得的人类胚胎;健康志愿者处收集的脐带血(CB)样本。
scRNA-seq样本:E11.5、E12.5、E13.5和E14.5时期小鼠的胎肝细胞。
空间转录组学分析样本:E14.5时期小鼠胚胎。
研究策略
利用单细胞转录组测序技术,绘制胎肝血细胞和微环境细胞发育的转录组图谱,解析造血干/祖细胞和微环境细胞的转录组动态变化。通过生物信息学分析和移植实验验证,发现富集干性较强的造血干/祖细胞和细胞发育的调控因子。并使用CellPhoneDB方法构建微环境细胞和造血干/祖细胞的互作调控网络,鉴定潜在的促造血干细胞扩增分子。
通过绘制胎肝的空间转录组图谱,验证互作细胞和配对信号分子的空间关系。利用空间转录组数据具有空间坐标的特征,研究人员将微环境细胞与造血干/祖细胞的空间关系分为三类。通过定性和定量分析,发现巨噬细胞高度富集的特征和细胞互作关系。
研究成果
1. 小鼠发育过程中的胎肝单细胞转录组图谱
研究人员构建了E11.5、E12.5、E13.5和E14.5四个时期的FL发育中每隔一天的单细胞分辨细胞图谱(图1a)。为了富集HCs和ECs,在这些时间点使用荧光激活细胞分选术(fluorescence-activated cell sorting,FACS)从FL中分离出HCs、ECs和非造血/非内皮细胞,然后将它们按照一定的比例汇集在一起进行测序。最终对32,449个单细胞进行UMAP分析(图1b),得到了21个细胞群(图1c),包括18个HC细胞群和3个结构生态群,它们的比例与发育阶段动态相关。随后,研究人员通过对四个发育时间点的细胞群进行差异分析和富集分析(图1d、1e),阐述了胎肝发育过程中HSCs/MPPs和结构生态位细胞在细胞组成、细胞类型特异性基因表达及阶段特异性生物学功能。
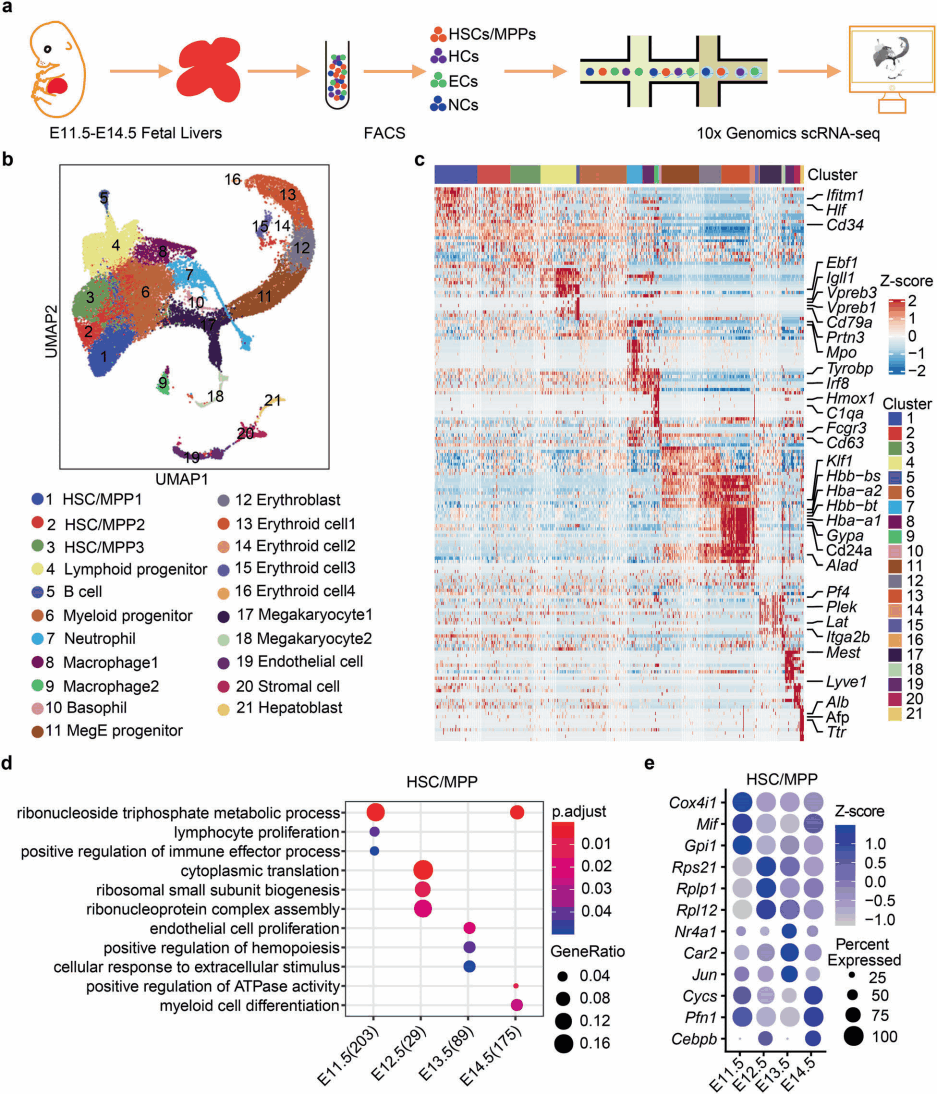
图1 发育中小鼠FL的单细胞转录组图谱
2. 富含CD93的HSCs/MPPs表现出增强的干细胞特性
为了进一步剖析HSCs/MPPS的转录组特征,研究人员重点研究了HSC/MPP1-3簇,并探索了它们之间的潜在差异。GO和DEG分析表明(图2a),在HSC/MPP1中,Mycn、Mecom和HLF的表达丰富;在HSC/MPP2中,代谢和谱系特异性基因高度表达;在HSC/MPP3中,细胞周期相关基因的表达高度富集(图2b、2c)。为进一步评估异质性HSCs/MPP的干细胞特性,通过hsc评分和轨迹分析(图2d、2e),最终得出结论:与HSC/MPP2-3相比,HSC/MPP1表现出最强大的干细胞转录组功能。此外,研究人员鉴定了细胞表面标记基因——CD93,相对于HSC/MPP2-3,该基因在HSC/MPP1中表达上调(图2f)。接下来通过CD93敲除小鼠的实验以及体外培养实验去探究这群细胞的作用,发现CD93不仅是表征HSC/MPP异质性的表面标志物,而且在功能上也是FL HSC/MPP发育所必需的(图2g~2j)。
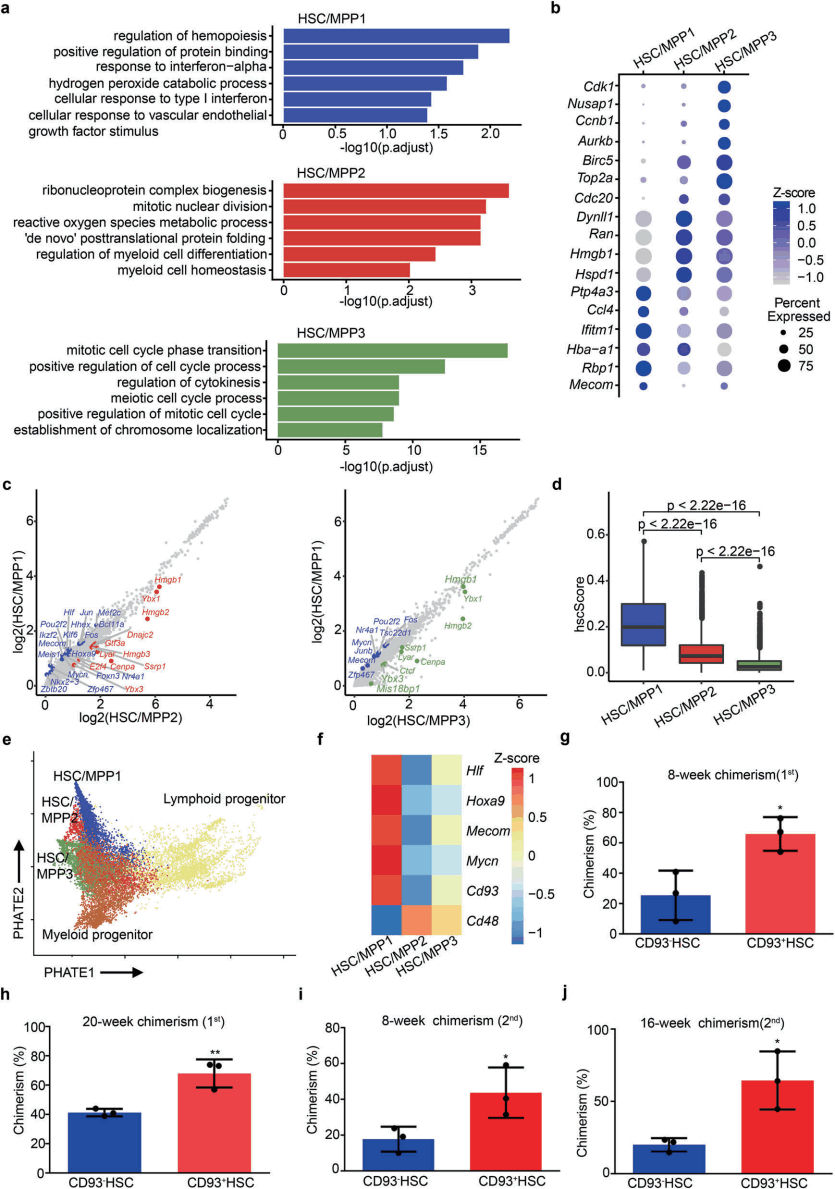
图2 CD93富集的HSCs/MPPs具有增强的干细胞特性
3. HSC/MPP和niche细胞之间的细胞-细胞相互作用
研究人员使用CellPhoneDB构建了HSC/MPP-niche细胞相互作用网络,并聚焦niche细胞和巨噬细胞(图3a)。除了一些已知的配体-受体关系对之外,也发现了一些新的与细胞生长、细胞因子识别、Notch信号相关的配体-受体对(图3b~3h)。
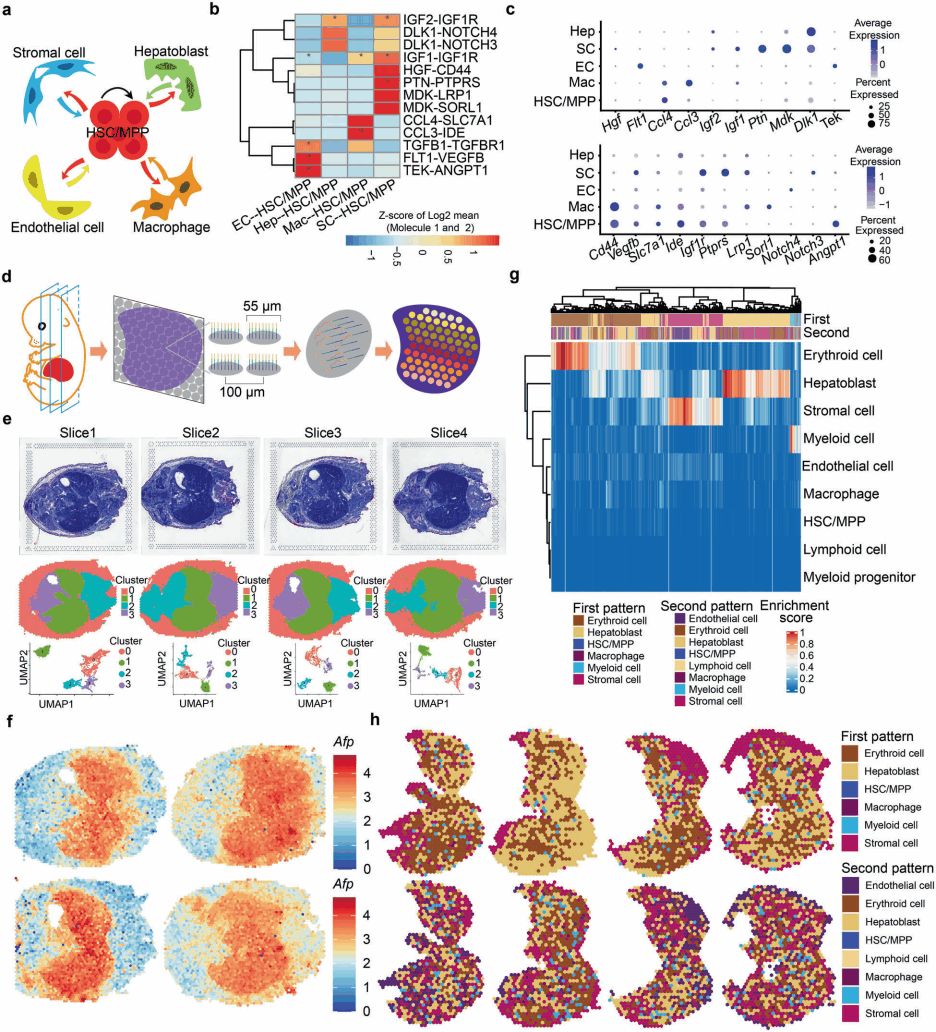
图3 HSCs/MPPs和niche细胞之间的细胞间相互作用
4. HSC/MPP扩增单位的识别
利用空间转录组数据具有空间坐标的特征,研究人员将微环境细胞与造血干/祖细胞的空间关系分为intra-spots(关系最为密切)、inter-spots(关系密切)和others distant spots(关系疏远)三类(图4a)。然后根据富集得分来识别各个spots的细胞类型(富集得分最高),除HSCs/MPPs外,intra-spots得分最高的是内皮细胞(endothelial cells,EC),与HSCs/MPPs接近;肝母细胞和基质细胞分别在inter-spots和others distant spots中得分最高;巨噬细胞在intra-spots和inter-spots中的得分高于others distant spots中的得分,因此巨噬细胞可以考虑是一种新的niche细胞。
在分子水平,研究人员使用CellPhoneDB分析来预测相互作用信号的空间表达,结果发现一些编码配体的基因,如MDK和PTN,在intra-spots和inter-spots的niche细胞中高表达,而与受体相关的基因,如LRP1和 PTPRS,在HSCs/MPPs定位的spots中富集(图4e~4i),说明空间邻近促进了信号的相互作用,从而在功能上支持HSCs/MPPs的扩增。鉴于intra-spots和inter-spots具有空间临近和相互作用信号丰富的特点,研究人员将其定义为扩增单元,其中HSCs/MPPs位于spots的核心,与周围的生态位细胞点(niche cell spots)相互作用(图4f、4h、4i)。
为了定量比较HSC/MPP与不同微环境细胞之间的相互作用,研究人员统计小鼠E14.5空间转录组数据,计算每个点与所有点的富集分数中位数比值,以该比值作为富集倍数。发现巨噬细胞在intra-spots显示出11.52倍的富集,在inter-spots间显示出1.31倍的富集,EC在intra-spots显示出1.62倍的富集,而肝母细胞和基质细胞在intra-spots中显示出较少的富集。
为了验证接近单细胞分辨率的空间关系,研究人员利用华大自主研发的具有亚细胞分辨率的时空组学技术Stereo-seq,分析了小鼠E13.5时期的胎肝时空数据,按照上述相同的分析方法,将20个bin定义为一个点(直径10~15μm,包括1~3个细胞),然后对Stereo-seq这些点(包括intra-spots、inter-spots和other distant spots)统计富集分数,发现巨噬细胞在点内和点间都表示出显著富集,该结果与CSOmap验证的一致。
总之,三种空间转录组数据分析结果支持巨噬细胞为与HSCs/MPPs关系最密切的重要微环境细胞。
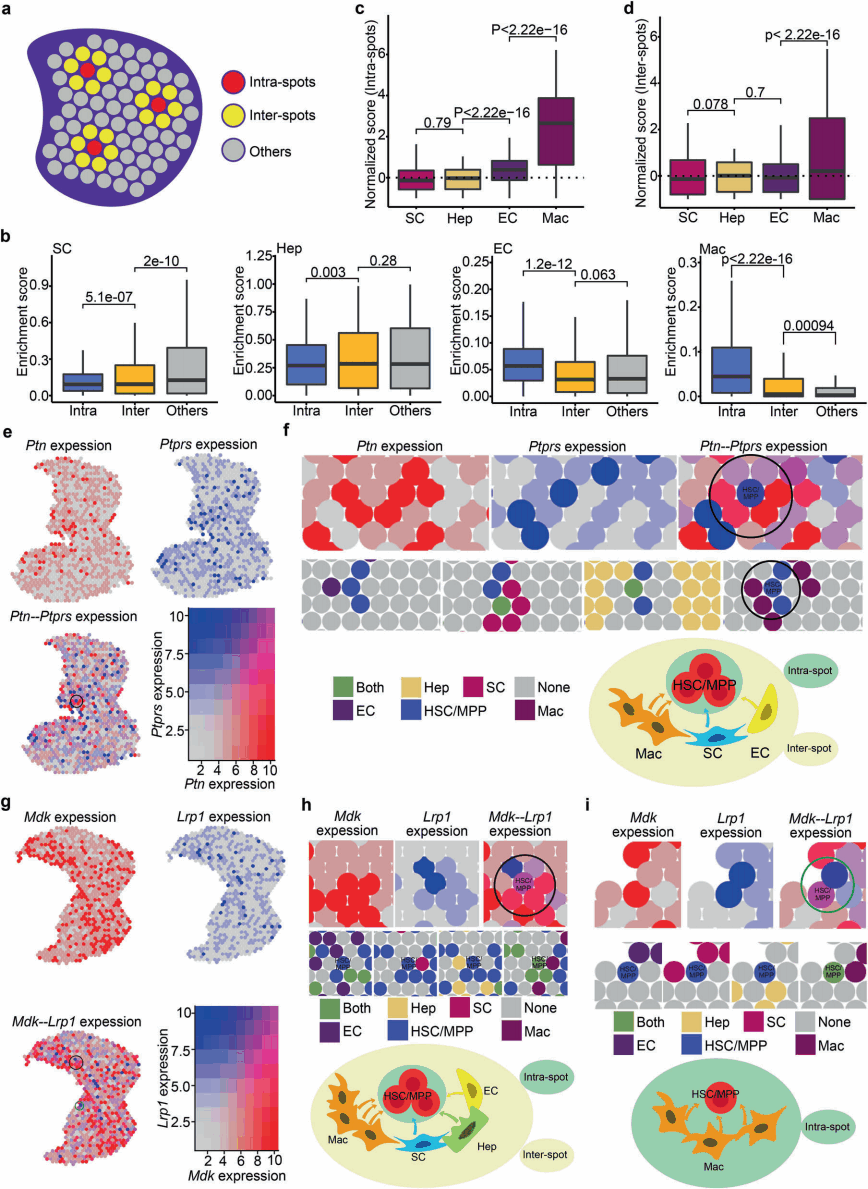
图4 HSC/MPP扩增单元识别
5. Niche细胞促进HSC/MPP扩增作用的功能验证
为了确定巨噬细胞在FL中如何调节HSC/MPP的扩增,研究人员在E14.5中探究了HSCs/MPPs与巨噬细胞之间的空间关系。免疫荧光实验揭示了两种空间模式:一种是HSCs/MPPs与近端巨噬细胞附着;一种是HSCs/MPPs被巨噬细胞包围(图5a~5d)。后一种模式表明巨噬细胞可能通过形成一种“口袋状”的结构来促进HSC/MPP的扩增。
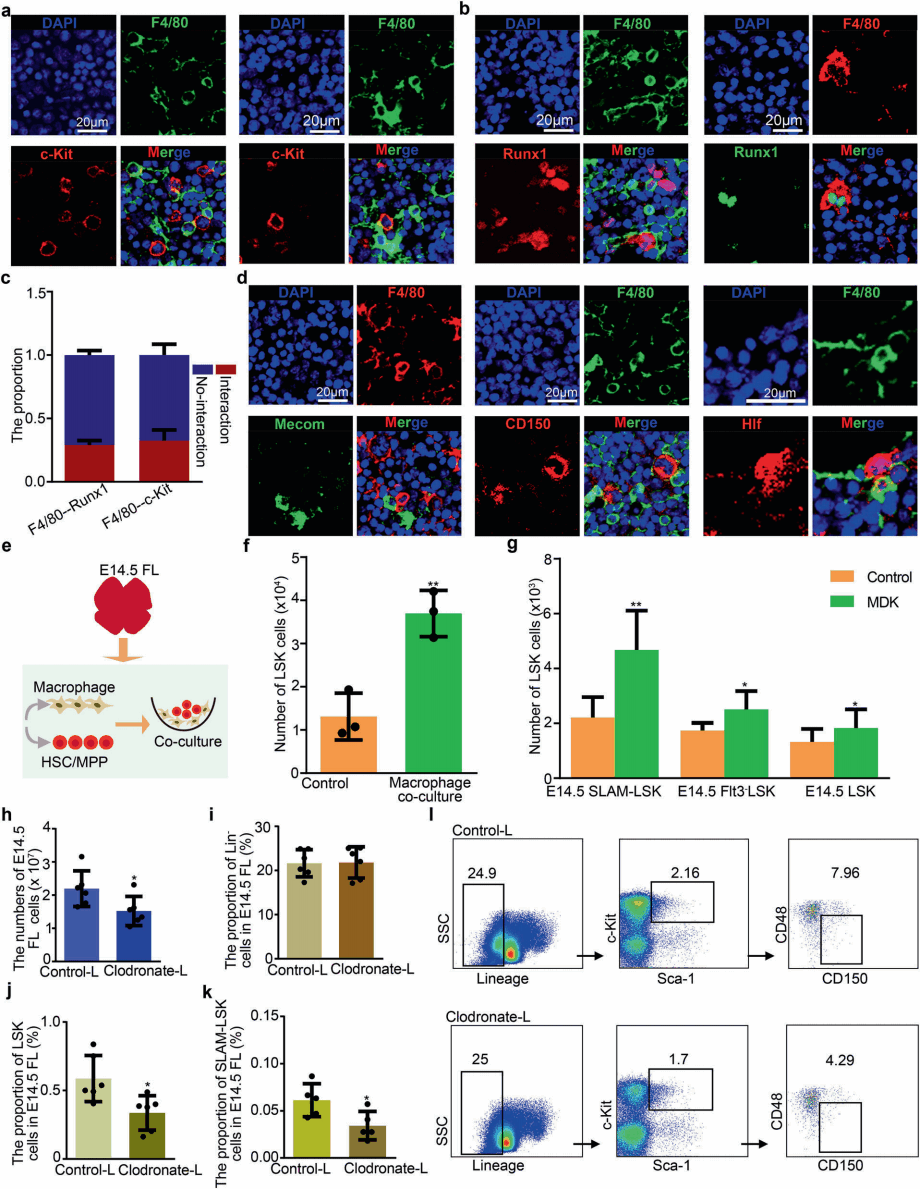
图5 巨噬细胞促进HSC/MPP扩增
研究人员进行了生物信息学分析、免疫荧光成像和共培养试验,确定了EMP和HSCs/MPP来源的巨噬细胞都在支持HSC/MPP扩增方面发挥了重要作用。通过检测HSCs/MPPs与ECs之间的空间关系,更加详细地描述了HSCs/MPPs的EC形成生态位(图6),并验证了潜在的细胞间相互作用和支持HSCs/MPPs扩增的潜在分子机制。
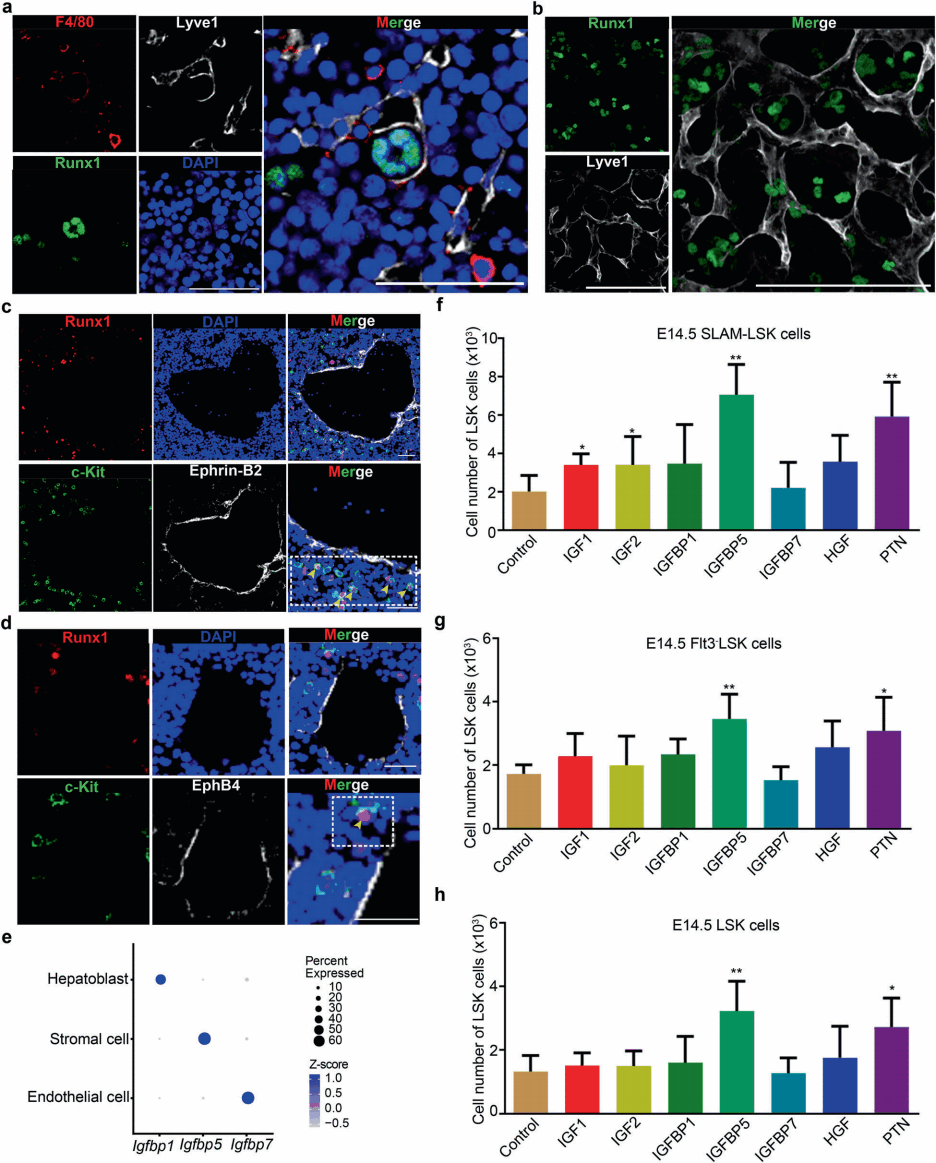
图6 促进HSCs/MPPs扩增的结构生态位细胞
6. 小鼠和人类FL造血功能的跨物种分析
为了分析小鼠和人类FL造血的保守性和差异性,研究人员将其scRNA-seq数据与最近发表的人FL的scRNA-seq图谱进行了比较。总共有6,325个来自受孕后11周的人FL的单细胞和8,404个来自E14.5的小鼠FL的单细胞进行了无监督UMAP分析(图7a)。综合分析表明,小鼠和人类FL细胞类型和HSCs/MPPs多谱系(红细胞/髓细胞/淋巴细胞)分化途径融合良好(图7b)。此外,小鼠和人类FL细胞类型的比较表明,大多数细胞类型高度相关。这些数据结果揭示了小鼠和人类FL之间保守的细胞类型和造血分化途径。
通过将小鼠胎肝和已发表的人FL单细胞转录组数据比对分析,鉴别了39个在人类和小鼠中保守的规范HSC/MPP特征基因。进一步GO分析发现(图7c、7d),因为生活环境的不同,小鼠HSC/MPP可能对病原体引起的炎症更具抵抗力,而人类HSC/MPP可能更容易受到辐射诱导的DNA损伤。因此,HSC/MPP这些不同的转录组特征的存表明,尽管总体上相似,但也存在对外界刺激的适应性反应的物种特异性机制。
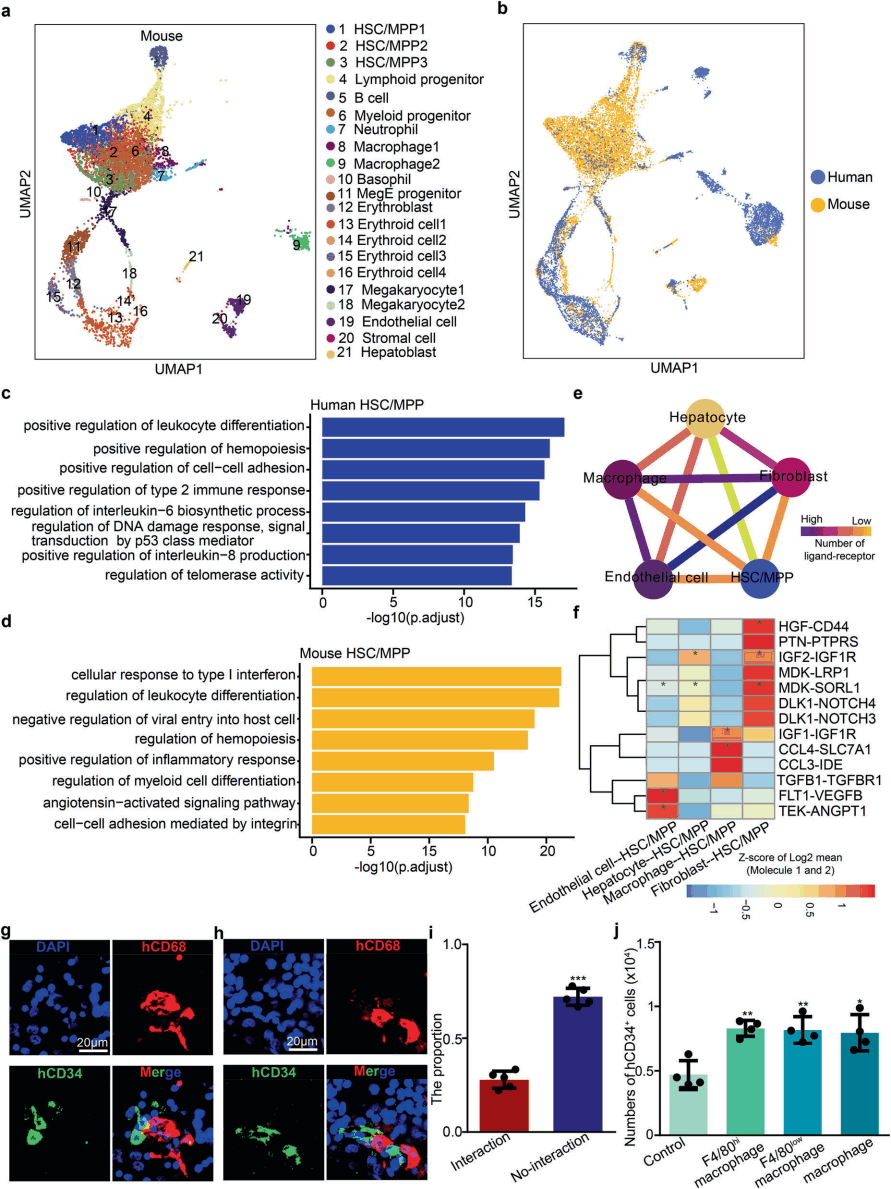
图7 小鼠和人类FL造血功能的跨物种分析
总 结
此研究使用高通量的scRNA-seq和空间转录组的ST框架构建了小鼠胎肝(FL)的时空转录组图谱。通过单细胞转录组学数据分析发现了3个转录异质性的HSC/MPP亚群,其中一个CD93富集的亚群表现出增强的干细胞特性。此外,通过单细胞和空间转录的综合分析,发现了新的HSC/MPP扩增的“口袋状”单元(HSC PLUS),由niche细胞(肝母细胞、基质细胞、内皮细胞和巨噬细胞)组成,并富含生长因子。出乎意料的是,巨噬细胞在HSCPLUS单位富集,巨噬细胞-HSC/MPP共培养实验和候选分子检测分别验证了巨噬细胞和生长因子(MDK、PTN和Igfbp5)在HSC/MPP扩增中的支持作用。最后,跨物种分析和功能验证表明,小鼠和人胎肝HSCs/MPPS之间存在保守的细胞间相互作用和扩增机制,但转录组特征存在差异。
综上,该研究首次绘制了小鼠胎肝发育的单细胞时空转录组图谱,鉴定了造血组织功能单元(HSCPLUS),深化了对体内造血干细胞扩增方式的理解,扩充了对组织功能单元的认识,也为体外扩增造血干细胞提供了更多线索。
数据集获取网址:
https://bigd.big.ac.cn/gsub/i,登录号分别是CRA002489和CRA003651。








