2025年4月9日,中国医学科学院肿瘤医院联合三亚华大生命科学研究院,在国际知名学术期刊Nature Communications发表了乳腺癌空间转录组学研究最新成果 。
研究人员利用华大自主研发的单细胞转录组平台DNBeLab C4和时空组学技术Stereo-seq,首次构建了全面的乳腺癌高分辨率空间转录组图谱,精细刻画了肿瘤血管系统表型与空间的异质性,并突破性地揭示了由微静脉内皮细胞和微静脉平滑肌细胞共同构建的“小静脉生态位” (venular niche) 通过趋化因子信号协同调控淋巴细胞浸润肿瘤的关键机制,为开发增强乳腺癌免疫治疗疗效的新策略提供了重要靶点和理论依据。
 文章页面截图
文章页面截图
乳腺癌在我国占全身各种恶性肿瘤的7%~10%,且呈逐年上升趋势,部分大城市中排在女性恶性肿瘤的首位。国内每年有30万左右女性被诊断出乳腺癌,早期死亡率一般为10%~20%,而晚期乳腺癌,尤其是广泛转移的患者,死亡率可高达90%。近年来,免疫检查点抑制剂和化疗联合治疗三阴性乳腺癌取得了一定进展,但在治疗其他分子分型患者方面疗效仍然有限,部分原因是肿瘤微环境(TME)免疫浸润不足。
为了更深入地了解TME异质性和决定免疫浸润的机制,优化免疫治疗效果,研究人员描述了30例手术切除的原发性乳腺肿瘤和配对淋巴结转移标本的空间结构和细胞通讯,发现肿瘤血管系统在生物学表型、空间组织和与周围细胞的相互作用方面表现出明显的异质性。CCL21+静脉平滑肌细胞(SMCs)和ACKR1+静脉内皮细胞(ECs)通过多种趋化因子共同促进乳腺癌淋巴细胞浸润从而提高生存率。
研究人员利用时空组学技术Stereo-seq对来自23例乳腺癌患者的30个新鲜冷冻组织进行了空间转录组测序,包括23例原发性乳腺癌和7例配对的转移性淋巴结,涵盖了所有四种分子亚型(luminal A: n = 8;luminal B: n = 9;HER2: n = 8;三阴性:n = 5)。并采用DNBelab C4系统对6例相邻肿瘤组织进行单细胞转录组测序(scRNA-seq),以便在ST(Spatial Transcriptomics )切片中推断细胞类型。
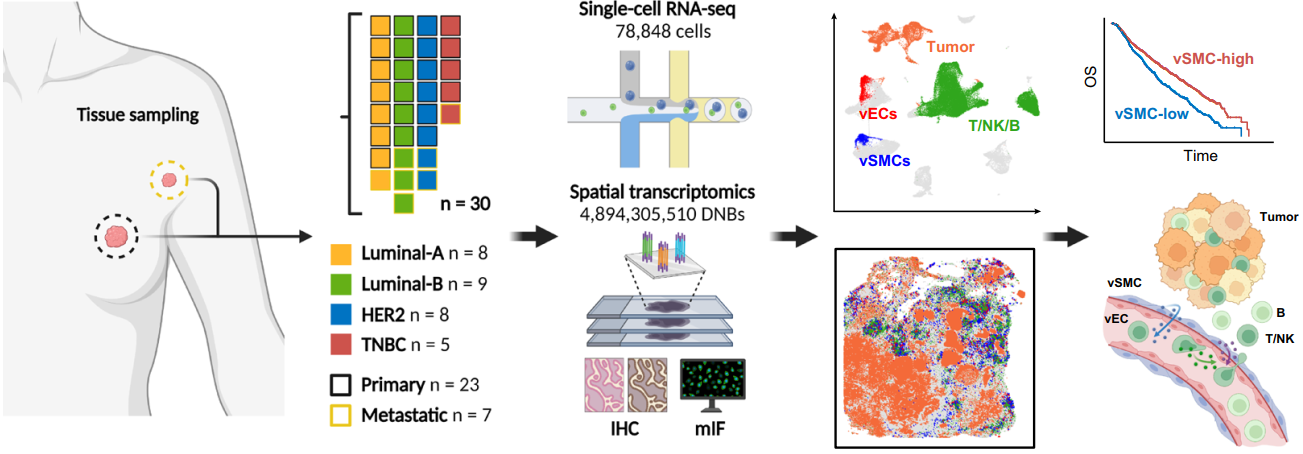 scRNA-seq和Stereo-seq分析工作流程设计图
scRNA-seq和Stereo-seq分析工作流程设计图
推断空间上细胞类型后,将ST切片细胞组成信息映射到病理专家注释的HE染色的切片上。转录组图谱和组织学注释的整合揭示了原发肿瘤和转移性淋巴结中各种细胞的详细分布,从而进一步表征了TME的微妙结构。在30张切片中,肿瘤细胞占绝大多数,平均比例为56%。基质细胞(包括内皮细胞、SMCs和成纤维细胞)和免疫细胞(包括B细胞、T/NK细胞和巨噬细胞)的比例相当,通常在5%至10%之间。与原发肿瘤相比,配对淋巴结转移癌变区域中T/NK和B细胞浸润显著增加。
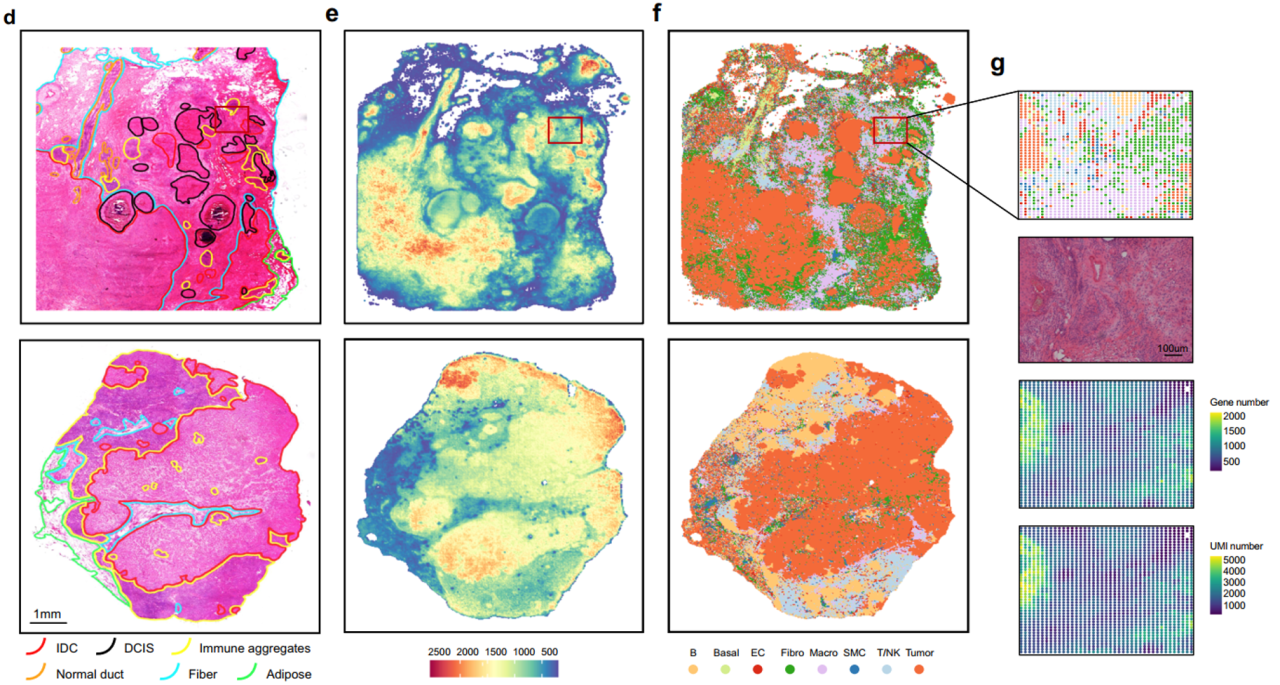
H&E病理分区、空间基因表达热图和细胞类型分布模式
接下来研究人员对乳腺癌样本中的内皮细胞(EC)和平滑肌细胞(SMC)进行亚聚类分析,发现小静脉内皮细胞(vEC)和小静脉平滑肌细胞(vSMC)在空间上具有独特的空间共定位模式,且这种共定位模式能够促进B、T和NK细胞等免疫细胞向肿瘤区域浸润从而提高病人的生存率。
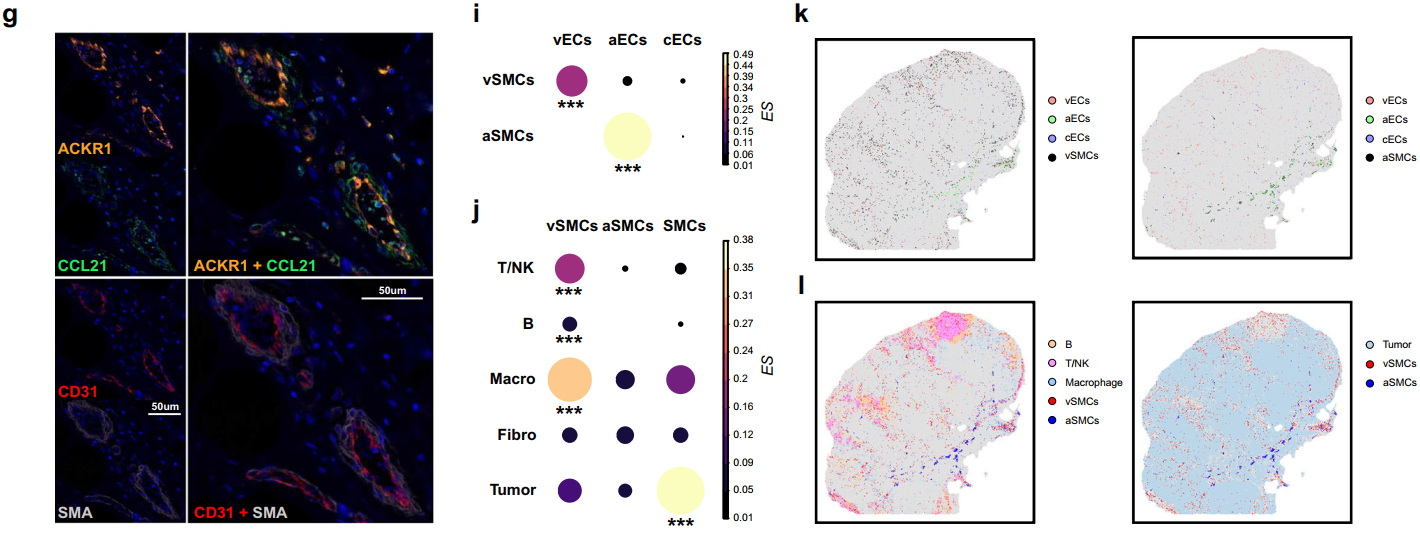
IHC、富集评分和空间共定位分析都显示vEC和vSMC共定位
通过基因共表达模块和细胞互作分析发现vEC与vSMC主要通过趋化因子基因相关的配受体发挥作用。当淋巴细胞被vSMC释放的CCL21/CCL19 吸引到小静脉微环境时,ACKR1+ vEC通过 ACKR1结合来自T/NK或 B细胞的CCL5 配体和来自小静脉平滑肌细胞的CCL2配体,促进小静脉平滑肌细胞和淋巴细胞之间的近距离通讯,并形成富含趋化因子的血管微环境,淋巴细胞在此被有效激活并穿过小静脉壁迁移,参与肿瘤内的抗肿瘤反应。最后研究人员通过内皮-PBMC共培养实验观察到ACKR1过表达的EC单层细胞显著提高了PBMC在CCL2或CCL5趋化刺激下的迁移能力。
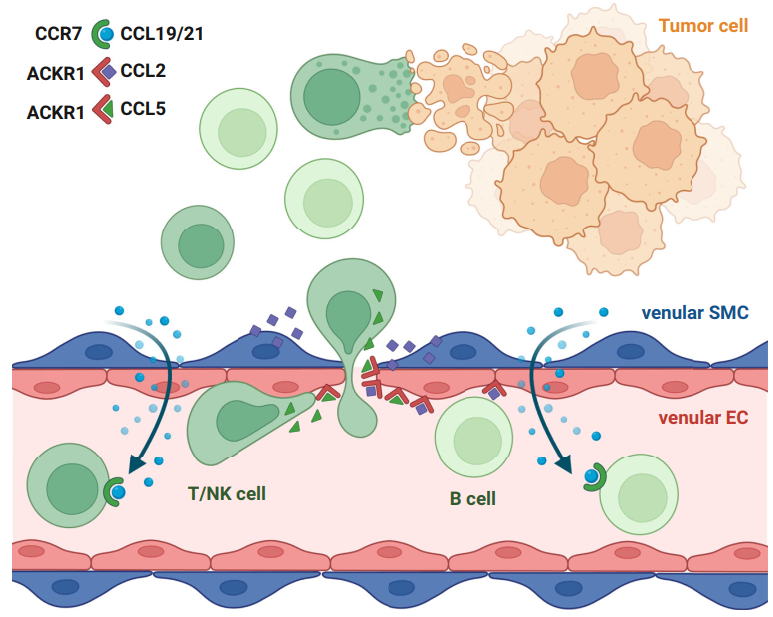
静脉SMCs和ECs协同作用增加淋巴细胞外渗的假设模型
该研究通过整合scRNA-seq和Stereo-seq数据,建立了30个人类乳腺肿瘤的四个分子亚型的空间分辨率转录组图谱,为全面描述原发性乳腺肿瘤和转移性淋巴结的生态系统提供了独特的资源。研究人员利用基于DNB的全基因组测序技术以公正的方式表征TME。与其他ST方法相比,纳米级分辨率映射能够更准确地表征肿瘤血管系统。该研究专注于阐明血管内皮细胞和SMC的空间和功能异质性,并发现静脉内皮细胞和SMCs创造了一个独特的促炎生态位,在这个生态位中,它们通过多种趋化因子合作,增强淋巴细胞趋化性和进入肿瘤。
综上,该研究是迄今为止对不同分子亚型人类乳腺癌的地理空间结构进行的最全面的调查。高分辨率转录组图展示了肿瘤脉管系统的表型和空间异质性,并表征了由静脉内皮细胞和SMC之间的协调驱动的免疫增强静脉生态位。对各种旁分泌信号回路的进一步功能验证可能会导致有效的血管靶向治疗,以提高乳腺癌患者免疫治疗的疗效。本研究已通过中国医学科学院肿瘤医院伦理审批。
中国医学科学院肿瘤医院应建明教授、孙楠教授、三亚华大生命科学研究院方晓东研究员、岳震研究员为论文通讯作者。中国医学科学院肿瘤医院王昕教授、王占宇博士、袁培博士、华大基因智惠医学研究院廖启军博士、三亚华大生命科学研究院梅俊谱博士、深圳华大生命科学研究院联合培养博士研究生张银博士为论文共同第一作者。
以上研究中使用到的产品方案为时空转录组FF,该产品方案目前已升级。升级后的时空转录组FF V1.3,在保持Stereo-seq技术“纳米级分辨率”和“厘米级全景视场”的两大优势下,通过优化时空试剂、酶、探针设计以及算法软件完成性能优化与提升。其捕获效率大幅提升,工作流程更快速简便,用户友好性显著增强,可助力研究人员轻松获得每个细胞内的更多高质量转录本数据,为各种应用场景下的科学研究提供无与伦比的洞察力。



 scRNA-seq和Stereo-seq分析工作流程设计图
scRNA-seq和Stereo-seq分析工作流程设计图


