杭州华大生命科学研究院、深圳华大生命科学研究院、昆明理工大学灵长类转化医学研究院、美国艾伦脑科学研究所、深圳国家基因库、中国科学院广州生物医药与健康研究院、广州市华珍生物科技等多家科研单位,基于华大DNBelab C4单细胞建库平台、DNBSEQ测序平台和华大自主研发的时空组学技术Stereo-seq,绘制了首个食蟹猴大脑的时空单细胞图谱,鉴定了不同皮层、不同脑区的兴奋性神经元的差异和调控网络,并指出了神经疾病易感性的特殊脑区的细胞类型。该文章在2022年11月8日发表于Nature Communications,在此,我们特邀请第一作者雷莹博士对文章进行详细解读。

文章题目:Spatially Resolved Gene Regulatory and Disease-Related Vulnerability Map of the Adult Macaque Cortex
发表时间:2022-11-08
发表期刊:Nature Communications
主要研究团队:杭州华大生命科学研究院、深圳华大生命科学研究院、昆明理工大学灵长类转化医学研究院、美国艾伦脑科学研究所、深圳国家基因库、中国科学院广州生物医药与健康研究院、广州市华珍生物科技等
影响因子:17.694
DOI:10.1038/s41467-022-34413-3
研究背景
非人灵长类动物(non-human primates,NHP)与人类在解剖结构、组织器官功能等方面非常相似,为研究人类神经发育和神经精神疾病的特征提供了一个独特的模型。食蟹猴(Macaca fascicularis)的大脑皮层组织在许多方面与人类相似,如特化的初级视觉皮层和背、腹前额叶结构等,系统分析食蟹猴的大脑皮层细胞的表达调控机制,将对使用食蟹猴进行脑及神经性疾病模型研究具有重要的指导意义,并能为深入了解脑科学的复杂机制提供珍贵资源。单细胞基因组测序使研究人员能够以前所未有的分辨率研究皮质细胞的潜在多样性和调节机制。而近年来,空间转录组技术的发展使将基因表达谱分配到皮层组织的空间坐标上成为可能。在本研究中,研究人员试图了解转录和表观遗传调控状态如何在功能不同的皮质区域中有所不同。
研究样本
snRNA-seq和snATAC-seq:三只72个月龄雌性食蟹猴端脑的初级视皮层(primary visual cortex,V1)、初级运动皮层(primary motor cortex,M1)和前额皮质(prefrontal cortex,PFC)的样本。
Stereo-seq:两只60个月龄雌性食蟹猴端脑的V1、M1、PFC的OTC包埋样本。
研究策略
研究人员综合利用snRNA-seq、snATAC-seq技术和时空组学技术Stereo-seq,绘制食蟹猴不同脑区单细胞水平多组学图谱。首先通过生物信息学分析,在单细胞水平上构建食蟹猴大脑皮层的精细细胞图谱,并利用多组学技术分别鉴定出神经细胞、非神经细胞的转录组细胞亚型和表观组学细胞亚型,其中包括不同脑区不同皮层的兴奋性神经元。然后,利用与空间组的整合分析,以空间分辨的方式定义了特定细胞类型和特定区域的调控元件,并通过重建髓鞘的发育过程,找到了髓鞘发育的关键调控因子。最后,通过连锁不平衡回归分析(linkage disequilibrium score regression,LDSC)染色质可及性和转录组的细胞亚群,预测了神经系统疾病和神经精神疾病的风险易感性。
研究成果
1. snRNA-seq联合snATAC-seq解析成年食蟹猴大脑皮层的细胞类型
研究人员分别利用基于Smart-seq2的snRNA-seq和基于液滴的DNBelab C4 RNA-seq解析了成年食蟹猴大脑皮层(PFC、M1和V1)的细胞分型(图1a)。经过质量过滤和细胞聚类,共获得了11,194个单核Smart-seq2转录组(PFC6,715个,M11,943个,V12,536个)和127,003个单核DNBelabC4转录组(PFC30,844个,M162,263个,V133,896个)。根据已知的皮质细胞类型的标记基因的表达,注释出了兴奋性神经元(excitatory neuron,EX)、抑制性神经元(inhibitory neuron,IN)和非神经细胞[少突胶质细胞(oligodendrocytes,OLI)、少突胶质前体细胞(oligodendrocyte precursor cells,OPC)、星形胶质细胞(astrocyte,AST)、小胶质细胞(microglia,MIC)和内皮细胞(endothelia,Endo)]。其中EX细胞亚型由皮质层(L2/3、L4/5、L5和L6)和大脑半球或端脑内的神经元投射定义,即端脑内(intra-telencephalic,IT)、端脑外(extra-telencephalic,ET)、近投射(near-projecting,NP)和皮质丘脑(corticothalamic,CT)类型(图1b、1c)。
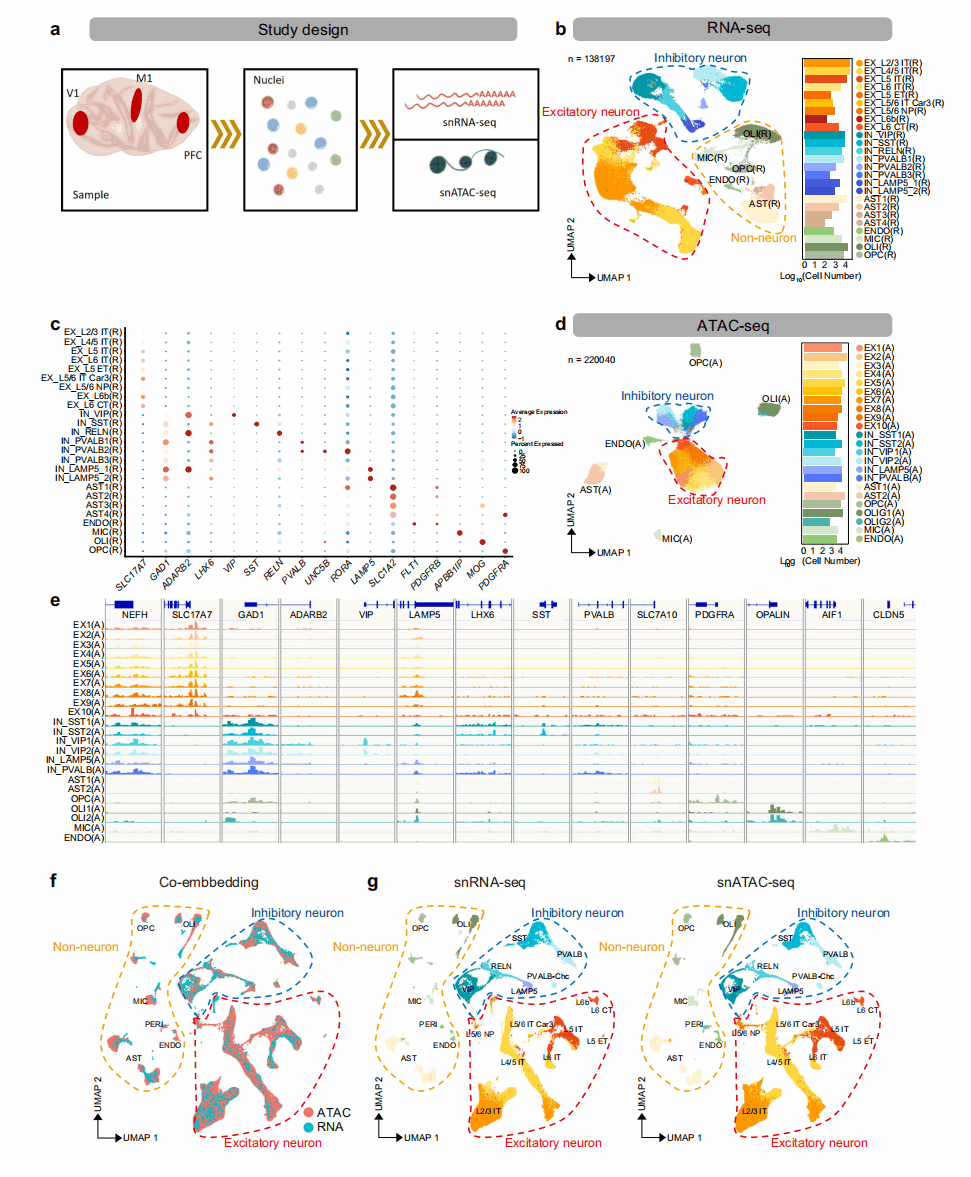
图1 食蟹猴大脑皮层的单核转录组和染色质可及性图谱
研究人员利用改进的组合条形码辅助的单细胞ATAC-seq和基于液滴的DNBelabC4ATAC-seq分析食蟹猴大脑三个皮质区域(PFC、M1和V1)的组织样本(图1a)。通过质量过滤,共得到220,040个合格的单细胞,其中72,714个细胞来自PFC,70,050个细胞来自M1,77,276个细胞来自V1。通过启动子可及性和基因活性得分,由脑细胞标记基因的ArchR计算,研究人员手动注释细胞群的身份(图1d),共鉴定了7种主要的皮质细胞群,包括EX、IN、OLI、OPC、MIC、AST和Endo。这四个IN亚簇可进一步归类为VIP、LAMP5、SST和PVALB(图1e)。为了将转录组状态与开放染色质联系起来,研究人员将皮质细胞的snRNA-seq和snATAC-seq数据整合(图1f)。在整合分析中,研究人员将snRNA-seq的亚型注释转移到了表观遗传的兴奋性神经元中(图1g),证明了表观遗传学和转录组数据在皮层细胞类型分类之间具有稳健的一致性,使进一步的整合分析成为可能。
2. 整合单细胞分析揭示兴奋性神经元的区域异质性
为了确定区域特定的染色质开放状态,研究人员使用snATAC-seq数据进行染色质可及性的区域间比较,并在snATAC-seq独立注释和共聚类结果(209,485个细胞)之间进行了一致的细胞类型识别,发现了PFC、M1和V1之间的83,110个差异可及位点(DApeak),涉及9种EX亚型。利用匹配的单细胞转录组和染色质可及性数据,研究人员建立了顺式调控元件(cis-regulatoryelements,CRE)与ArchR在每种细胞类型中的靶向基因表达的联系,识别了54,548对显著相关的Cre基因对,12,484个基因中每一个基因的中位数为3个Cre,与人类脑细胞类型中报道的相似(图2a),且大多数与基因连锁的Cre显示出细胞类型的特定分布(图2b)。此外,研究人员发现对于大多数兴奋性神经元亚型,DApeak靶向基因与PFC、M1和V1之间的差异表达基因之间存在显著重叠现象(图2c)。
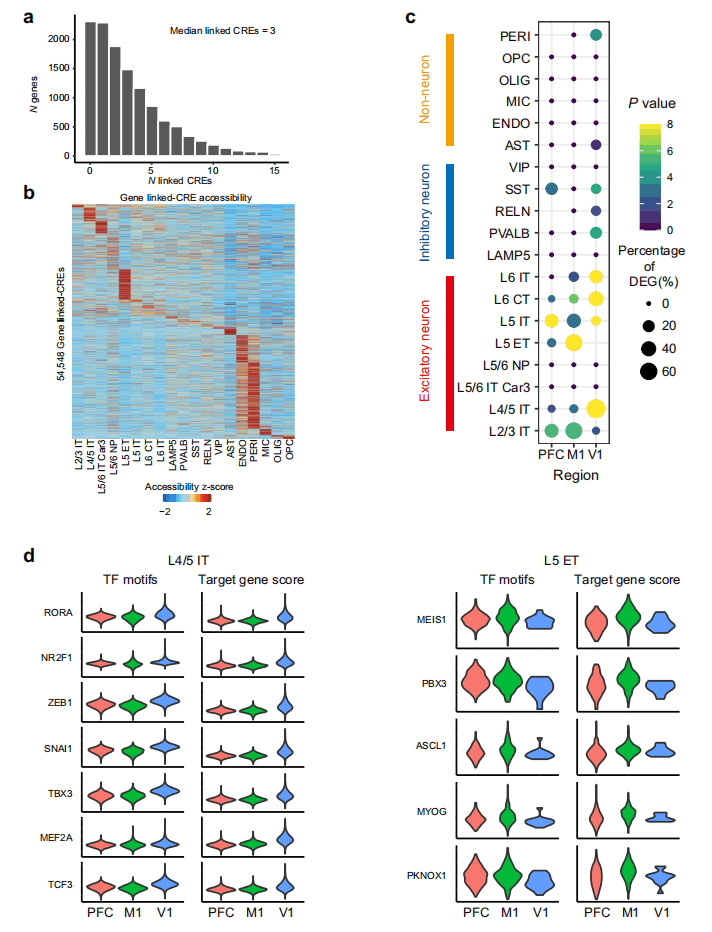
图2 细胞类型特异性和区域特异性基因表达的转录调控
为了进一步探索区域特异性表达的转录调控,研究人员首先用chromVAR测量了每个EX亚型中转录因子结合位点的富集度,并分析了PFC、M1和V1之间差异富集性的TF结合基序。在L4/5IT和L5ET中展示了转录因子的调控基因,研究人员发现L4/5IT的V1中ZEB1、MEF2A、RORA、NR2F1、SNAI1、TBX3和TCF3的靶基因活性显著增加。L5ET的M1中MEIS1、PBX3、ASCL1、MYOG、PKNOX1的靶基因活性显著增加(图2d)。然后,研究人员利用峰值基因连接和TF结合基序构建了TF调控的基因网络。在TFs的靶向基因中鉴定出了区域特异性的DEGs,并且区域富集的TF结合基序可以与远端调控的基因相连。
总之,上述研究数据揭示了食蟹猴皮层区域间转录组谱和染色质可及性的重叠,并确定了兴奋性神经元在区域异质性中的转录调控。
3. 食蟹猴前额叶皮质和运动皮质的转录特异性
大脑区域和层的近似是灵长类皮质基因表达关系的最强决定因素,这解释了为什么V1与PFC和M1相比具有更特异的转录模式。在这里,研究人员分析了PFC和M1在兴奋性神经元亚型中的差异表达基因,发现PFC和M1在EX亚型中分别上调了122个基因和159个基因(图3a)。已有报道在灵长类动物和小鼠运动皮质的L5脑外(L5ET)神经元中有特殊的功能和表达。在M1L5 ET中,研究人员发现了许多与钙离子转运有关的基因,如SLC24A2、ITPR2、CALM2和PDE4B (图3b)。为了确定EX亚型中PFC-和M1相关的特殊生物学功能,研究人员进行GO分析,发现许多富含M1的基因参与“肌肉收缩”,包括编码肾上腺素能受体和钙离子转运蛋白的基因,例如L6CT型参与了远程皮质-运动神经元投射;EX亚型中富含PFC的基因,L5ET中谷氨酸受体信号通路基因显著增加,包括GRIK1、GRIK2、GRID2和GRIN2B(图3b)。此外,研究人员发现许多轴突引导基因涉及皮质发育和精神障碍,如SLIT/ROBO信号成员SLIT1、SLIT3、ROBO1,以及信号素SEMA3E、SEMA6D。
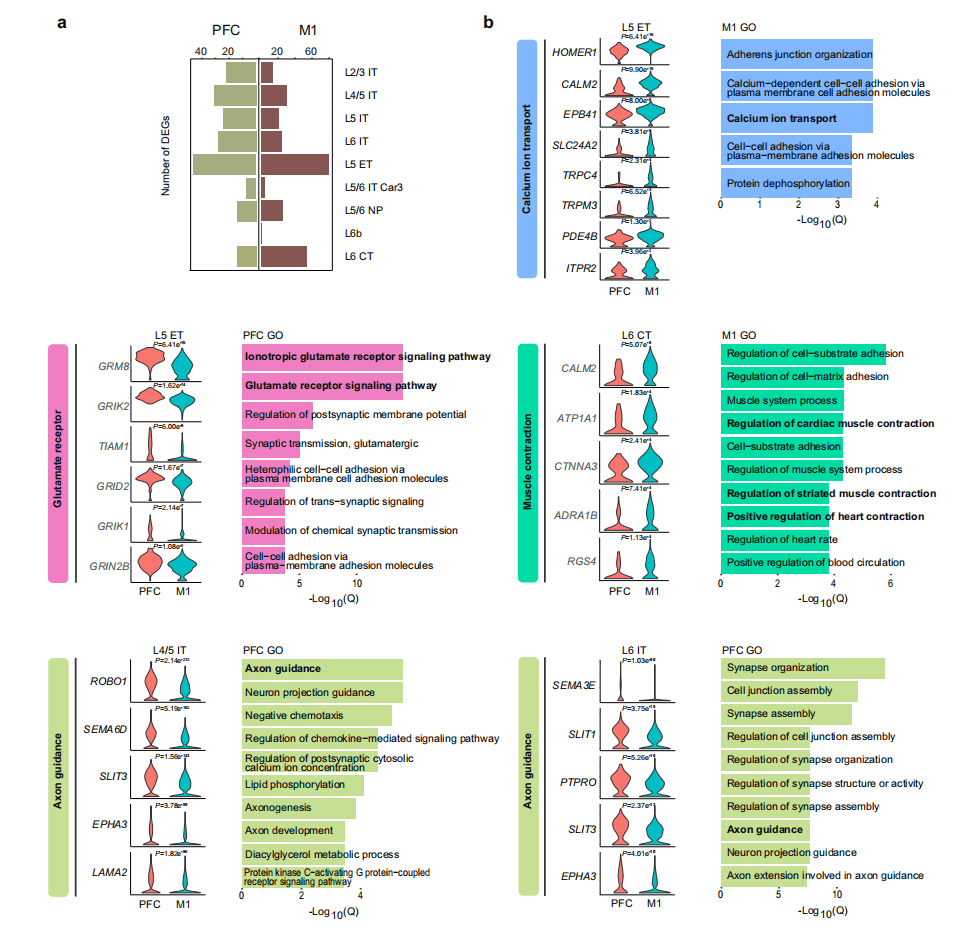
图3 食蟹猴前额叶皮质和运动皮质之间兴奋性神经元的转录组特异性
4. 通过Stereo-seq表征食蟹猴大脑皮质的空间基因表达
利用华大自主研发的Stereo-seq,研究人员通过DNA纳米孔(DNA nanoball,DNB)模式阵列芯片与原位RNA捕获结合,实现了组织切片的纳米级转录组分析。与其他相关技术相比,Stereo-seq具有500nm或715nm的分辨率,每100μm2捕获的spots数量明显更多。本研究中,研究人员分别使用10μm的食蟹猴PFC、M1和V1组织的相邻组织切片进行Nissl染色或Stereo-seq(图4a),发现细胞类型注释与食蟹猴大脑已知层标记的空间表达及相邻组织切片的组织学染色定义的皮质层高度一致(图4b~d)。然后,研究人员检测了PFC、M1和V1的Stereo-seq切片注释中snRNA-seq的PFC、M1和V1之间兴奋性神经元亚型的区域差异表达基因,发现Stereo-seq数据中也有大量基因表现出区域特异性,包括EX中已知和新发现的区域丰富基因(图4e)。总之,研究人员证明了单细胞基因组学和空间分辨转录组学的综合分析可以识别一致的区域多样性。此外,研究人员还在原位捕捉到了不同皮质区域的一致梯度表达模式。
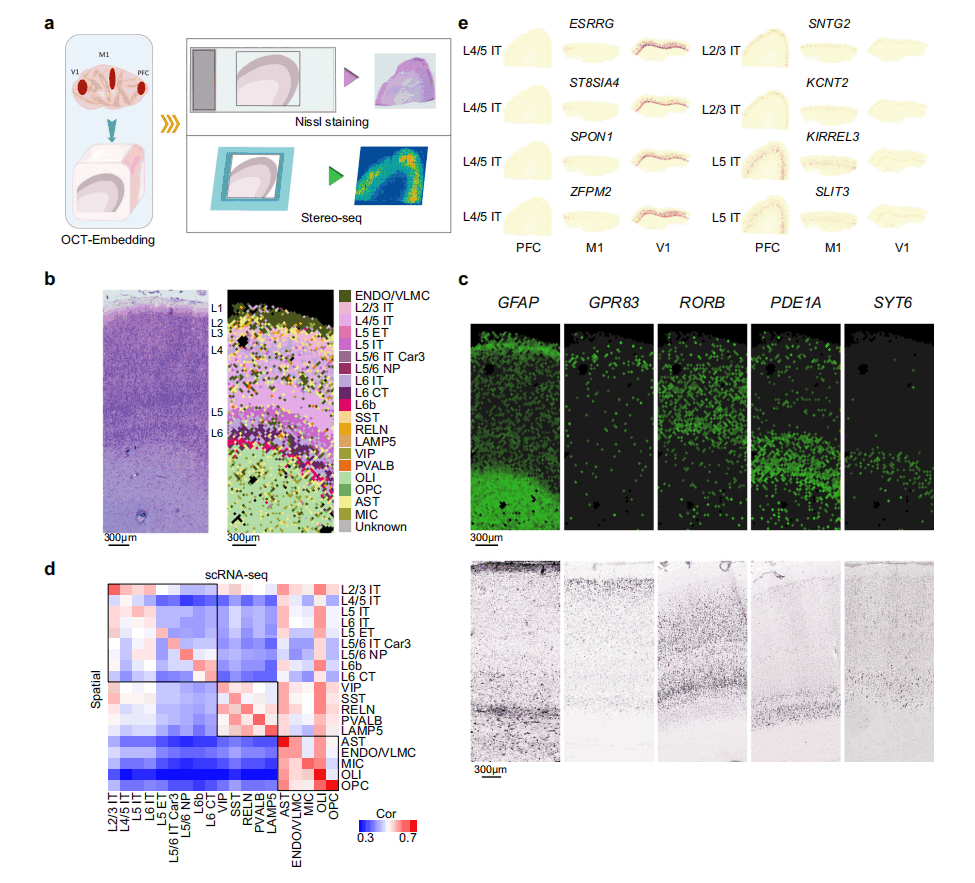
图4 Stereo-seq研究食蟹猴大脑皮质基因的表达
5. 少突胶质细胞发育轨迹的单细胞调控网络
OLI用髓鞘包裹神经元轴突以支持神经元功能。以前的研究工作已经报道了小鼠模型和人脑中OLI成熟和髓鞘形成的转录和表观遗传调控途径,但由于数据覆盖不足,无法评估这两层调控是如何动态相关的(图5a)。
研究人员用Monocle 2对细胞进行伪时间排序,使用基因表达和基因活性分数构建OLI轨迹(图5b、5c),结果显示,在小鼠和人类的OPC、成熟OLI中报告的标记基因的表达和活性评分也在该研究食蟹猴OPC(NEU4和PDGFRA)和OLI(MBP和PLP1)也富集(图5d、5e)。在这里,研究人员发现食蟹猴OPC与未成熟OLI中亲离子谷氨酸受体的丰富基因表达和较高的表观遗传学评分。以往的研究表明,Wnt信号通路在OLI的发育过程中起着重要的阶段特异性和多功能调节作用。研究人员的数据表明,参与Wnt信号转导的基因在OPC中富集。
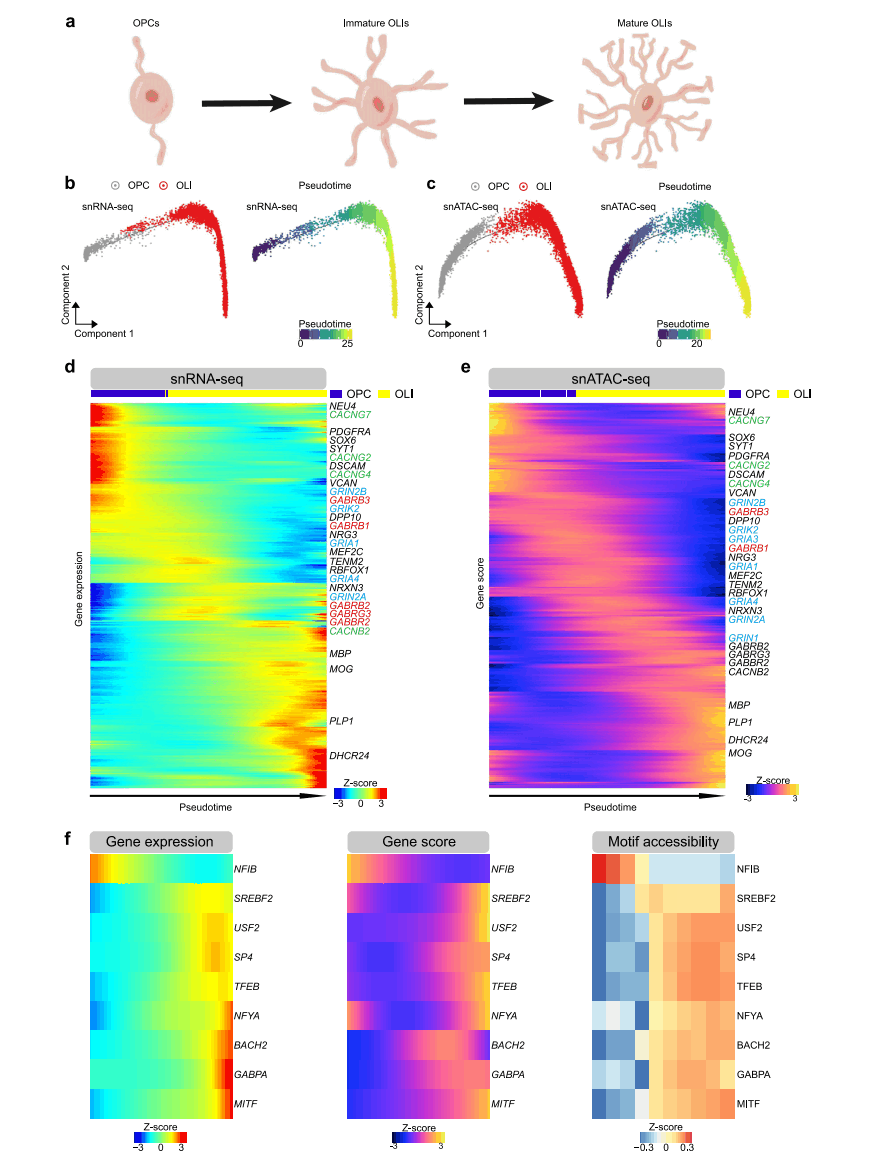
图5 少突胶质细胞的发育轨迹和调控网络
接下来,研究人员将chromVAR TF偏差分数沿着伪时间轨迹映射到细胞,确定了129个定义少突胶质细胞成熟过程不同阶段的转录因子。此外,研究人员还利用OPC和OLI中的峰基因链接和TF结合基序丰富构建了TFs调控网络,在TFs靶基因中鉴定了OPC和OLI之间的DEG,进一步分析发现了9个具有一致的基因表达和基因活性分数/基序可及性特征的TF(图5f)。
综上,基于对单核转录组和染色质可及性的综合分析,确认了OLI成熟的主要调控因子,为进一步研究脱髓鞘疾病的功能提供了候选对象,并展示了成年人类和食蟹猴脑中少突胶质细胞轨迹的保守调控景观。
6. 将人类的特征和疾病映射到大脑皮质细胞类型
将细胞类型的特定调控元件与全基因组相关研究(GWAS)中发现的疾病风险变量联系起来,可以帮助了解特定的细胞类型是否有助于疾病的病理生物学,这反过来又可以成为开发靶向治疗方法的工具。在这里,研究人员对食蟹猴皮质细胞类型中人类神经和神经精神疾病风险因素的丰富程度进行了评估,以证明数据集的稳健性。与人类和小鼠神经特征风险的细胞类型图谱研究一致,研究人员发现重度抑郁症(major depressive disorders,MDD)和精神分裂症(schizophrenia,SCZ)等神经精神特征的遗传力显著富集(图6a)。将SCZ基因变异显著富集映射于L2/3IT型兴奋性神经元和SST抑制神经元,研究人员发现仅在M1中L5和L6IT富集。前额叶皮层的MDD遗传力富集已被报道,本研究中MDD的遗传变异在PFC和M1中都比较富集,但在V1中不富集。相反,自闭症障碍(autism disorder,ASD)的SNP遗传度在M1和V1的兴奋性神经元中显著富集,而不是PFC。与已知在非脑相关自身免疫性疾病中受影响的细胞类型一致,研究人员发现小胶质细胞中存在哮喘、甲状腺功能减退和湿疹的SNP遗传性增加。
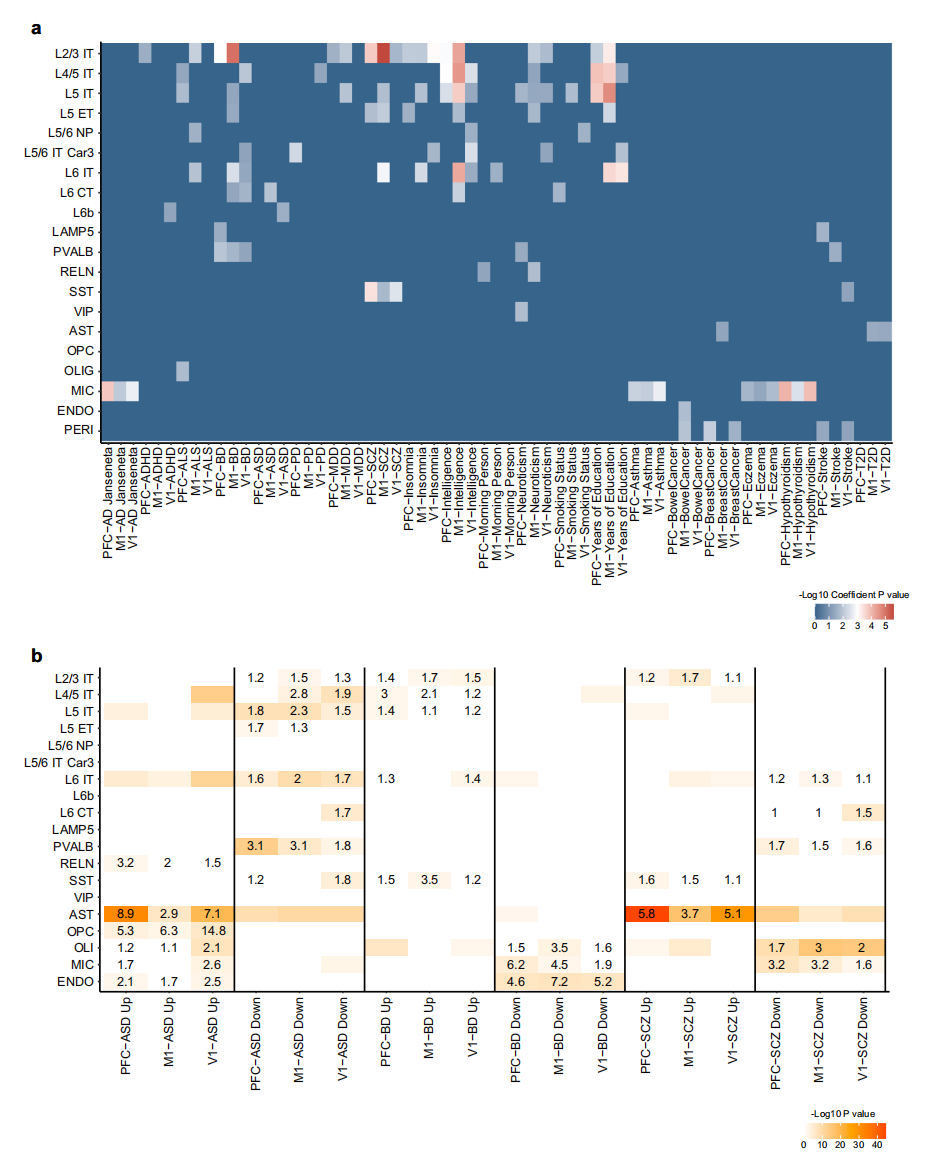
图6 疾病风险在脑细胞类型的富集
研究人员整合大规模死后脑组织水平的转录组数据和本研究Stereo-seq食蟹猴皮质组织数据集,研究了ASD、双相情感障碍(bipolar disorder,BD)和SCZ患者的差异表达基因。结果显示,ASDDEGs在三个脑区的L5IT和L6IT中都有富集,而在L2/3IT的富集只出现在M1(图6b)。与最近对SCZ患者PFC样本的单细胞转录分析一致,研究人员发现SCZDEGs在兴奋性神经元亚型中广泛丰富,其中PVALB型是受影响最大的抑制亚型。此外,ASD和SCZ相关的扰动在所有三个区域的星形胶质细胞中都高度丰富。最后,通过结合表观遗传学和空间转录组分析,研究人员生成了一个可以提供关于遗传和疾病状态下的细胞类型和皮质区域特定程序的临床见解的资源。
结论
应用snATAC-seq和snRNA-seq分析来自食蟹猴三个主要皮质区域(V1、M1和PFC)的358,237个单细胞,并对这些皮质区域进行Stere-seq检测,每个区域获得了超过30,000个spots(Bin),研究人员构建了成年灵长类动物皮质的空间分辨的大规模单细胞开放染色质和转录图谱。相对于单基因或更定性的方法,在综合分析框架中应用多组学数据可以提高细胞类型注释的分辨率和置信度。
髓鞘功能障碍是几种神经退行性疾病和神经发育障碍的特征,包括多发性硬化症。该研究中,研究人员定位了特定基因表达的变化,染色质状态和调控电路如何影响细胞在整个谱系成熟过程中的命运决定,定义了主要调节因子的角色,并确定了脱髓鞘疾病的潜在靶点。此外,对OLI轨迹的比较分析揭示了食蟹猴和人类之间共同和不同的基因激活和转录因子调节。最后,研究人员使用细胞类型特定的电磁场数据和空间分辨的Stereo-seq数据来预测神经和神经精神疾病的风险。除了先前报道的人类和食蟹猴之间疾病相关基因表达的异时性和异位性差异外,研究人员进一步证明了正常人类和食蟹猴之间共同和不同的细胞类型富集的疾病遗传风险基因。
本研究中提供的数据:
数据集获取网址:https://db.cngb.org/mba。
原始数据通过CNSA数据库获得,数据编号为CNP0000927;分析代码获取网址:https://github.com/single-cell-BGI/MBA。
作者:雷莹







