文章页面截图
胎盘是妊娠期间母体与胎儿之间的重要连接器官,负责为胎儿提供营养,清除废物。此外,胎盘还参与激素的产生和调节,以及调控母体的免疫系统,维持胎儿的正常。滋养层细胞是胎盘的主要构成细胞之一,它们在妊娠早期会侵入子宫蜕膜,这一过程被称为滋养层细胞侵入。这一步骤对于胎盘的植入和形成至关重要。滋养层细胞的侵入深度和范围在不同物种间存在显著差异,并且这一过程的失调与多种妊娠并发症相关,如宫内生长受限(FGR)和子痫前期(PE)。
1. 使用scRNA-seq解码大鼠胎盘发育过程中的单细胞转录组图谱
研究者在大鼠的三个关键胎盘发育阶段(E9.5:胎盘形成的初始阶段;E12.5:滋养层细胞停留在胎盘连接区;E15.5:滋养层细胞深度侵入子宫)收集了胎盘样本,这些样本进行了单细胞转录组测序(scRNA-seq)。经过质控后,保留了66,524个细胞进一步分析;通过降维和无监督聚类分析,鉴定出了7种主要的细胞群,包括滋养层细胞、免疫细胞、基质细胞、内皮细胞、血液前体细胞、红细胞和内脏内胚层。分析中意外地发现了一个表达免疫细胞标记基因(如Ptprc)和滋养层细胞标记基因(如Krt7)的细胞群,他们将这个细胞群命名为免疫特征滋养层细胞(iTrophoblast)。这些细胞在大鼠胎盘中的比例约为1.40%,并且在胎盘侵入过程中可能发挥重要的调节作用。文章还对基质细胞、免疫细胞和内皮细胞进行了亚群分析,发现了不同的细胞亚群,并对其进行了功能性分析,发现基质细胞的某些亚群与细胞外基质的组织和血管生成过程相关。
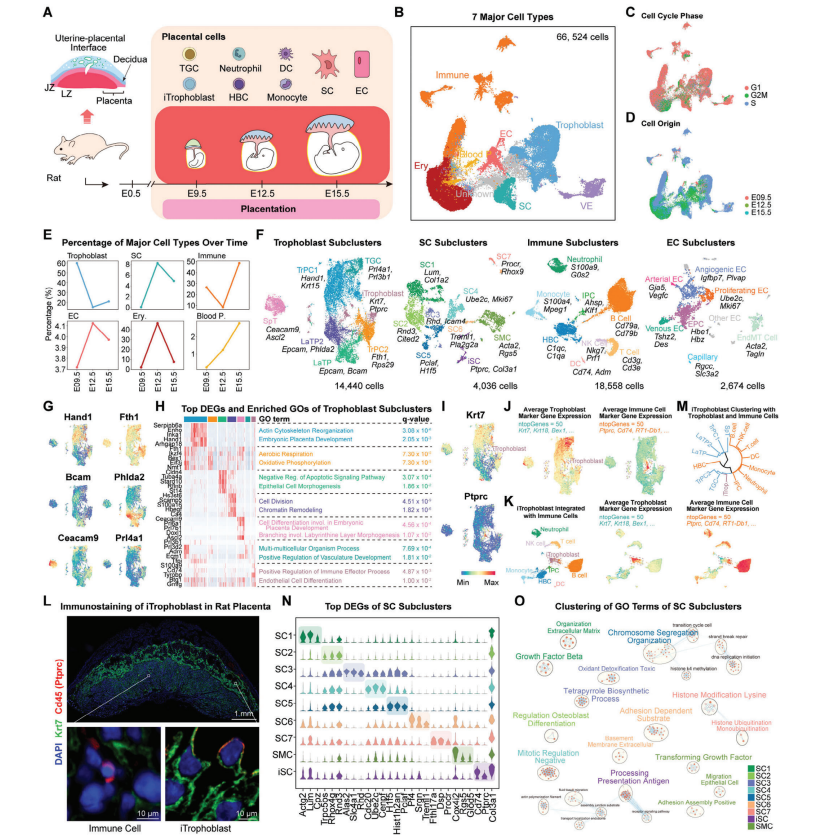
图1. 利用scRNA-seq解析大鼠胎盘发育过程中的单细胞转录组特征
研究者收集了怀孕不同阶段(P16、P20、P24、P28)的猪胎盘样本,这些样本被用于进行单细胞测序。经过质控后,保留了63,918个猪胎盘细胞进行后续分析。通过聚类分析,鉴定了七种主要的细胞群,包括滋养层细胞、免疫细胞、基质细胞、内皮细胞、红细胞、内脏内胚层和平滑肌细胞。文章还对滋养层细胞进行了重新聚类,以获得更详细的亚群信息。总共鉴定了五个不同的非侵入性滋养层细胞亚群,每个亚群表达不同的特定基因。第一型上皮绒毛滋养层细胞亚群(Tr1)在细胞黏附和迁移中富集,主要存在于妊娠第16天,参与了猪胚胎的植入过程。第二型亚群(Tr2)则参与胎盘营养物质的转运,而第三型亚群(Tr3)则与“胎盘脊的形成”相关。与大鼠胎盘的分析类似,文章还对猪胎盘中的基质细胞、免疫细胞和内皮细胞进行了亚群分析。这些细胞亚群在胎盘的血管生成、细胞迁移和免疫调节中可能发挥作用。
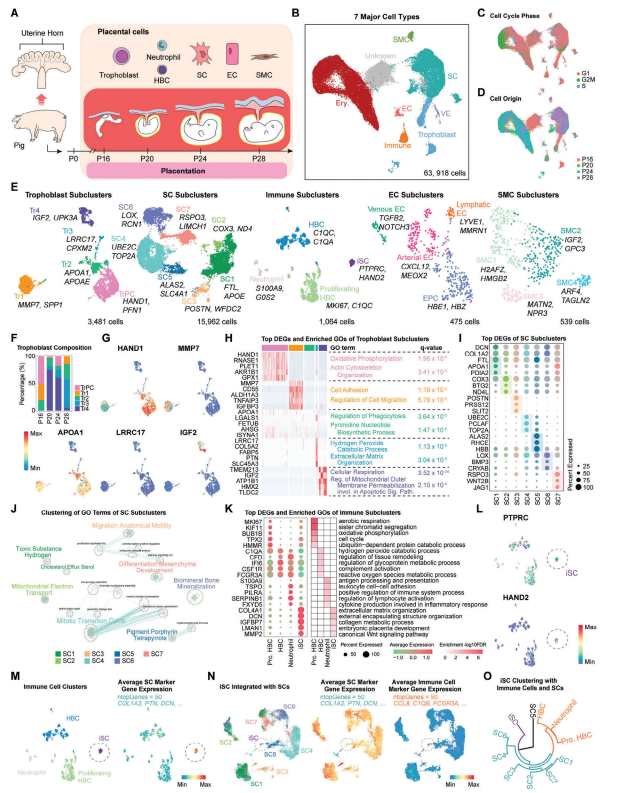
图2. 构建猪早期胎盘发育过程中的单细胞转录组图谱
为了更好地理解胎盘化过程中的调控差异,研究人员选择了大鼠、猪以及从公共数据库下载的小鼠胎盘数据进行比较分析。文章用标识的侵入性滋养层细胞标记基因来定义计算了大鼠和猪胎盘中所有滋养层细胞的侵入性指数。发现大鼠中的侵入性滋养层细胞(TGCs)具有最高的滋养层细胞侵入性指数,这跟小鼠胎盘中TGCs的结果一致。猪的Tr1滋养层细胞亚群也表现出高侵入性指数。基于对Tr1亚群的以上功能分析,推测这种滋养层细胞群的侵入性有助于胎盘组织与子宫内膜细胞的紧密结合,从而缩短了血液间距离。通过对大鼠TGC和猪Tr1中的13,515个同源基因进行加权基因共表达网络分析(WGCNA)鉴定出了9个不同的基因表达模块(M1-M9),这些模块中的基因在TGC和Tr1中具有不同的基因表达模式,与胎盘发育相关,并具有不同的生物功能。
同时还进行了蛋白-蛋白相互作用(PPI)分析,识别出了调控侵入性滋养层细胞发育的关键基因。研究还发现iTrophoblast仅在大鼠和小鼠的侵入性溶血性胎盘中被鉴定出来,而在非侵入性胎盘细胞中没有发现。进一步对大鼠中获得的iTrophoblast群体进行了重新聚类,鉴定出了具有不同转录组特征的3个亚群,用拟时序分析发现这3个iTrophoblast亚群,在不同阶段的细胞组成与胎盘发育呈逐步变化的关系。
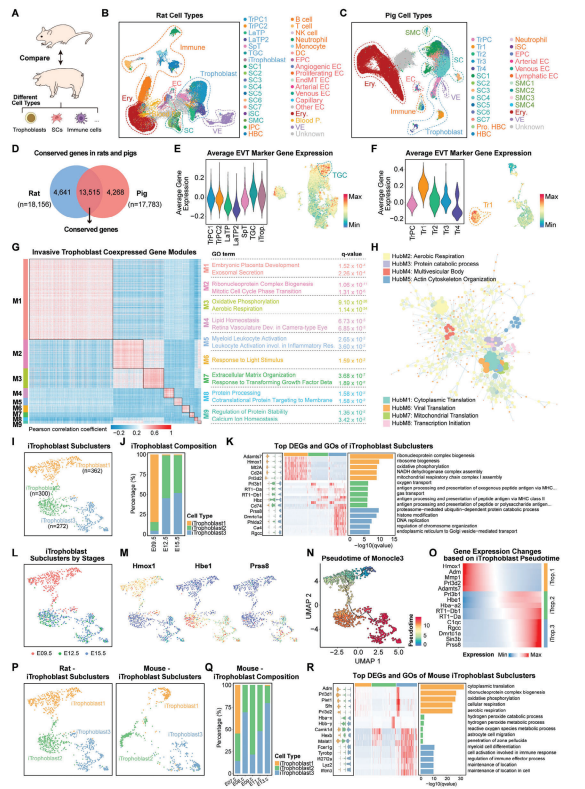
4. 调节人类子痫前期中滋养层细胞侵入的功能性细胞紊乱
为了确定在PE中哪些特定的细胞功能障碍可能导致滋养层细胞侵入失败,以及这些细胞紊乱如何影响胎盘功能从而导致PE的发展,研究者收集了人类正常和PE胎盘样本进行单细胞测序分析,并与先前公开数据库的数据进行整合。结果显示,与正常胎盘相比,PE胎盘中的细胞类型和比例发生了显著变化,其中绒毛外滋养层细胞(EVT)的比例较低。EVT在PE胎盘中与正常胎盘的转录组也显示出有明显差异。在PE胎盘中,与胎盘侵入相关的基因表达下调,预示PE胎盘中的 EVT 的功能紊乱可能是疾病的一个重要原因。
在人类的侵入性溶血性胎盘中也发现了iTrophoblast,这些细胞表现出免疫细胞的特征。通过对人类PE胎盘中与正常胎盘中的两种 iTrophoblast类群进行比较,发现它们有显著的转录组差异,主要富集在调节血管生成、免疫系统和细胞基质粘附等生物过程中。成熟iTrophoblast和EVT亚群的差异表达基因中,细胞基质粘附和白细胞迁移等生物过程得到富集,表明成熟iTrophoblast可能调控胎盘侵入。进一步分析,识别出人类胎盘中五个具有不同转录组特征的iTrophoblast亚群,可能代表了其成熟过程中的不同转换状态。考虑到iTrophoblast在侵入性胎盘形成中的关键作用,研究者推测,PE胎盘形成过程中,iTrophoblast细胞的异常转化导致了大量不成熟iTrophoblast细胞的积累,可能导致胎盘侵入不足,从而促进PE的发展。
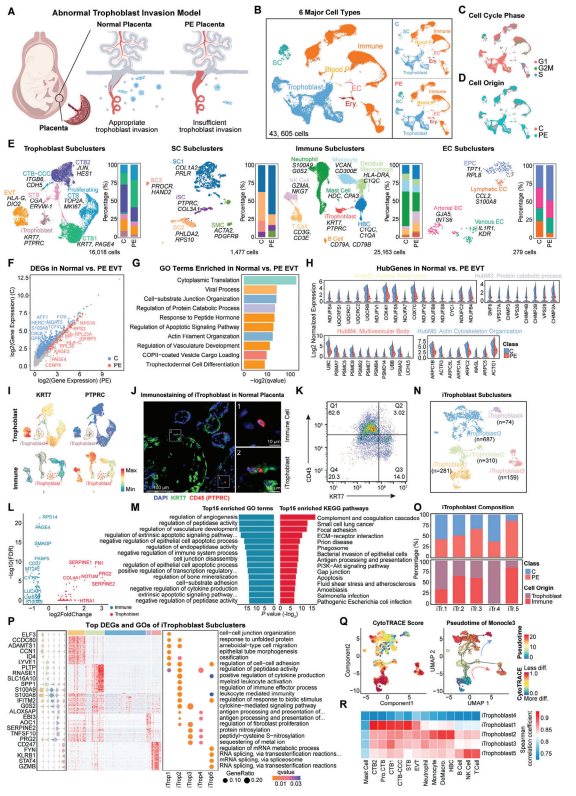
图4. 人类子痫前期胎盘滋养细胞侵袭功能失调
5. 使用华大时空组学技术Stereo-seq对正常及子痫前期胎盘中的免疫特征滋养层细胞进行空间识别和可视化
为了确定iTrophoblast细胞在正常和PE胎盘组织中的空间分布,可视化iTrophoblast细胞与其他胎盘细胞类型的相互作用,研究者收集了正常和PE人类胎盘组织样本,使用Stereo-seq进一步分析。观察到正常胎盘组织和PE胎盘组织中的iTrophoblast亚群在空间位置上相互重叠,这在一定程度上显示了iTrophoblast亚群之间的潜在转化。通过空间共定位分析发现,iTrophoblast2与Hofbauer细胞(HBC)、滋养层巨噬细胞和单核细胞之间可能存在相互作用。特定功能的iTrophoblast4与EVT和EC的空间共定位表明它在胎盘侵入过程中可能发挥不可或缺的作用。PE胎盘组织中iTrophoblast5与NK细胞和T细胞的空间共定位揭示了iTrophoblast2在先兆子痫胎盘中的异常转化。
此外,原位杂交实验证实了KRT8、PTPRC和特定的不同iTrophoblast亚群的基因的共表达,这与Stereo-seq的结果一致。这些结果为胎盘组织中的iTrophoblast亚群提供了精确可靠的验证。
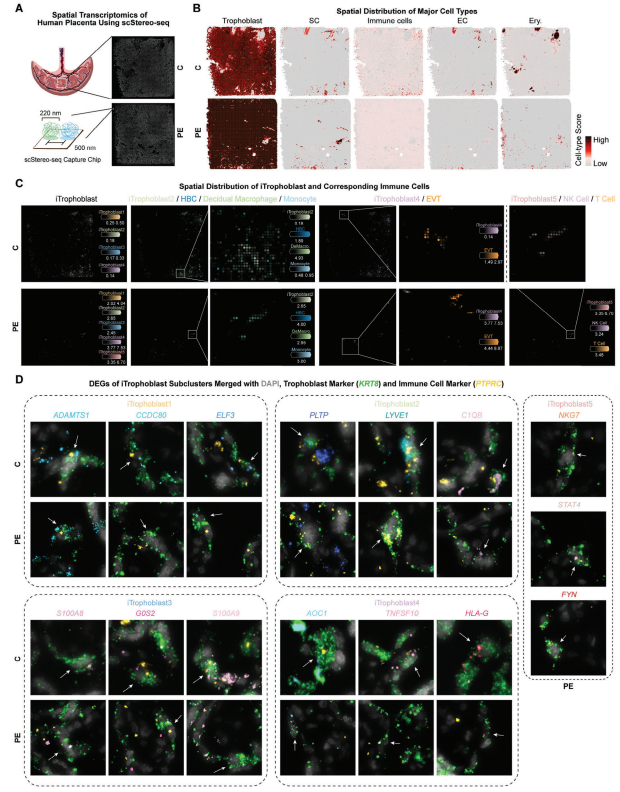
图 5. 利用Stereo-seq技术识别和可视化正常及子痫前期胎盘中的iTrophoblast滋养细胞
6. 功能失调及空间混乱的免疫特征性滋养细胞介导EVT 侵入失败和子痫前期
为了从分子角度理解iTrophoblast对异常滋养层细胞侵入和PE的病理效应,文章使用了CellChat细胞通讯的分析方法来识别PE与正常胎盘中不同类型细胞之间的信号通讯。分析发现,在PE胎盘中配体-受体的相互作用差异显著。正常胎盘中CXCL信号通路明显高于PE胎盘,而BMP信号通路则相反。这与先前的研究一致,说明CXCL通过吸引免疫细胞在母胎界面维持特殊的免疫微环境,同时参与血管生成和调节滋养层细胞侵入过程。比较正常胎盘和PE胎盘中所有细胞亚群的信号通路时,发现iTrophoblast2和HBC的相互作用信号通路明显异常。
通过分析iTrophoblast2到滋养层细胞和免疫细胞的输出信号通路,以及HBC向iTrophoblast和滋养层细胞的输出信号通路时,发现在PE胎盘中,iTrophoblast2通过CCL2/3/4与增殖型滋养层细胞(CTB)之间的相互作用缺失,但CTB2和滋养层细胞柱滋养层细胞(CTB-CCC)之间通过独特的BMP2/7相互作用。在HBC的输出信号通路中,其与增殖型滋养层细胞(CTB)之间通过CCL2/3/4/5/8/13的相互作用在PE胎盘中仍然缺失,但在正常胎盘中发现了其与功能性iTrophoblast4之间通过CXCL2/3/8独特的相互作用。
同时文章还发现几乎所有iTrophoblast4和EVT之间的相互作用在PE胎盘中消失,包括对于滋养层细胞侵入过程中重要的血管生成调节因子ANGPTL4的信号通路。综合这些结果,表明功能失调和空间组织混乱的iTrophoblast可能会破坏人类胎盘着床过程中的EVT侵入过程,并最终导致EVT侵入失败和子痫前症的发生。
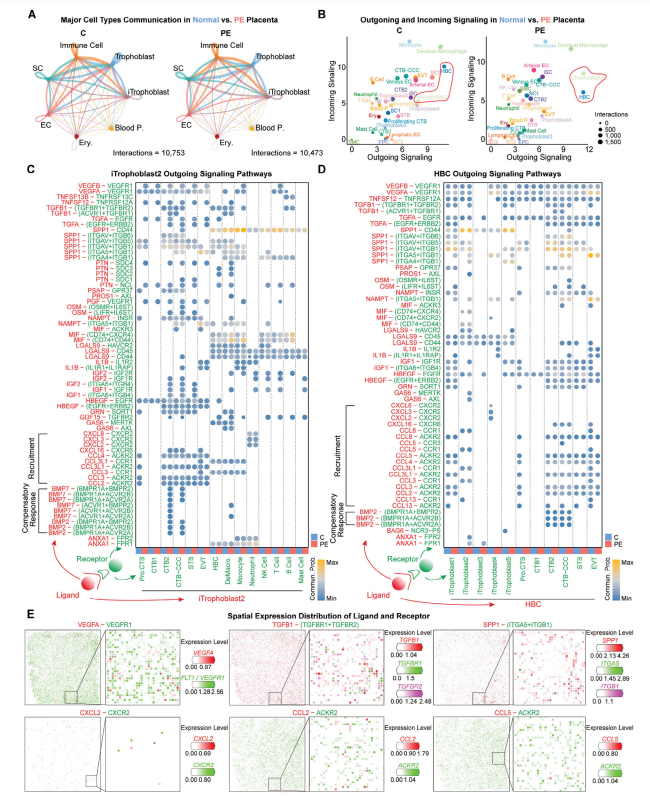
图6. 功能失调且空间排列紊乱的iTrophoblast滋养细胞导致胎盘EVT侵袭失败和子痫前期的发生
文章通过使用scRNA-seq和Stereo-seq,进行了跨物种比较和疾病模型分析,增进了研究人员对胎盘发育和子痫前期病理机制的理解,通过揭示iTrophoblast细胞在胎盘形成中的关键作用,为妊娠相关疾病的诊断和治疗提供了新的视角。







