近日,《Cell Discovery》期刊发表了两篇重要的研究论文。研究人员利用华大自主研发的高精度大视场时空组学技术Stereo-seq,以及单细胞转录组测序技术DNBelab C4,详细绘制了叙利亚仓鼠(金黄地鼠)感染SARS-CoV-2新冠病毒后,肺部从急性感染、严重肺炎到病毒清除及感染后期炎症消退的时空转录组全景图谱,揭示了整个感染过程中关键免疫细胞群体的变化及其相互作用特征。


单细胞时空分析揭示肺泡树突状细胞-T细胞免疫中枢在防御肺部感染中的作用
“Single-cell spatiotemporal analysis reveals alveolar dendritic cell–T cell immunity hubs defending against pulmonary infection”文章中,研究团队首先描述了金黄地鼠肺部感染全景图谱的构建方法。作者选用了8-10周龄的金黄地鼠,通过鼻腔接种SARS-CoV-2病毒,将25只金黄地鼠分为五个时间点:感染前(d0)、急性损伤期(d2)、急性免疫反应期(d5)、病毒清除期(d7)和炎症消退及组织修复期(d14),对肺组织进行了单细胞转录组和时空转录组测序,获得了142,965个细胞和45个肺叶的时空转录组信息。
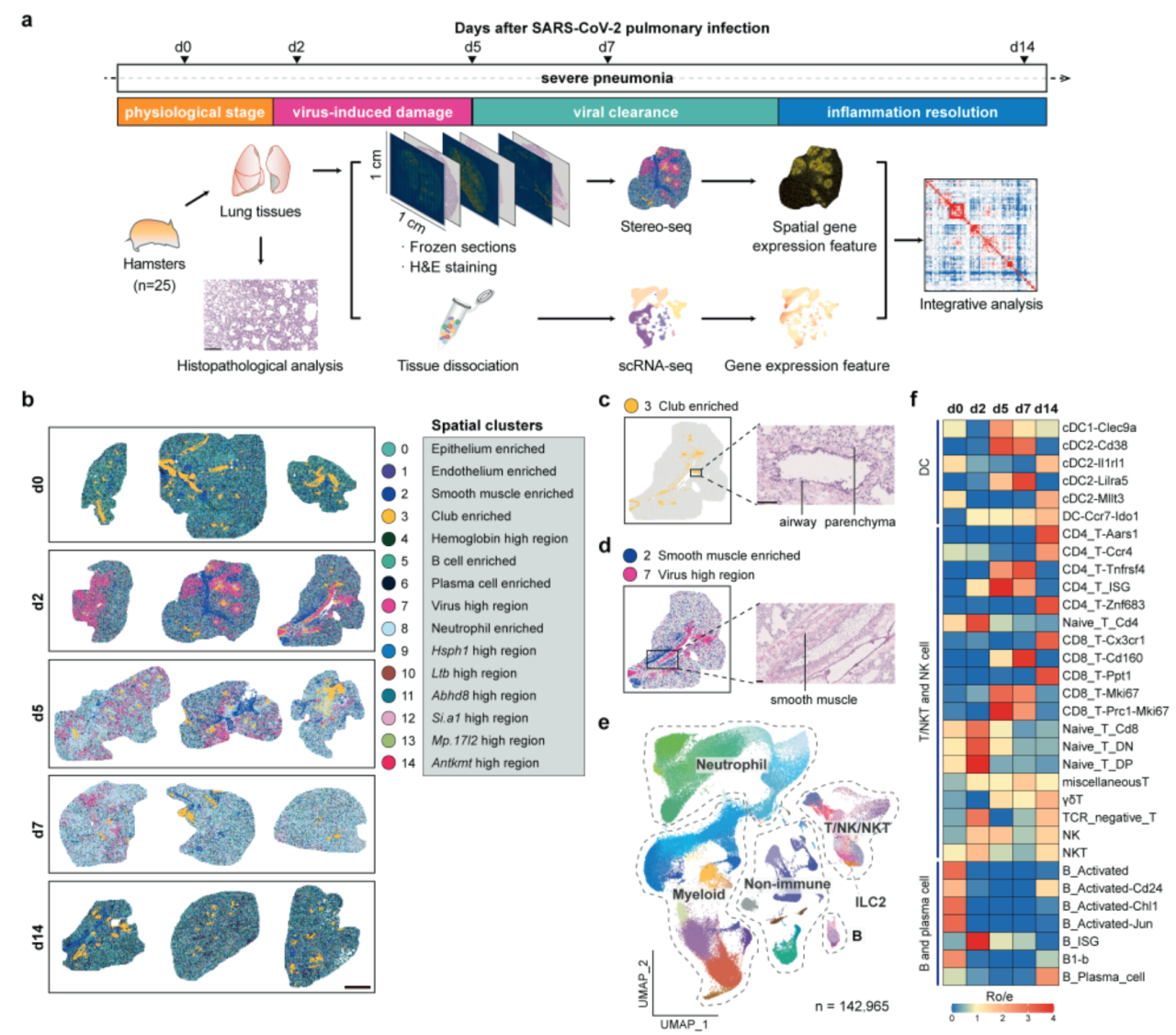
图1. SARS-CoV-2感染前后金黄地鼠肺组织的单细胞时空特征分析
通过无监督的时空聚类分析,研究团队发现肺组织可被划分为15个基因表达和分布特征不同的cluster(图1b)。例如,SARS-CoV-2的N基因在空间cluster 7中高表达,并在感染第2天达到峰值,随后显著下降,突显了时空转录组技术在解析病毒感染特征中的优势(图1b)。单细胞聚类分析揭示了79个细胞亚群,包括非免疫细胞、T/NK/NKT细胞、B细胞、髓系细胞等(图1e)。研究发现,树突状细胞(DCs)、T细胞、B细胞等多种免疫细胞在感染早期(d2至d7)数量减少,但在d14时部分恢复,与组织损伤及修复的过程一致(图1f)。
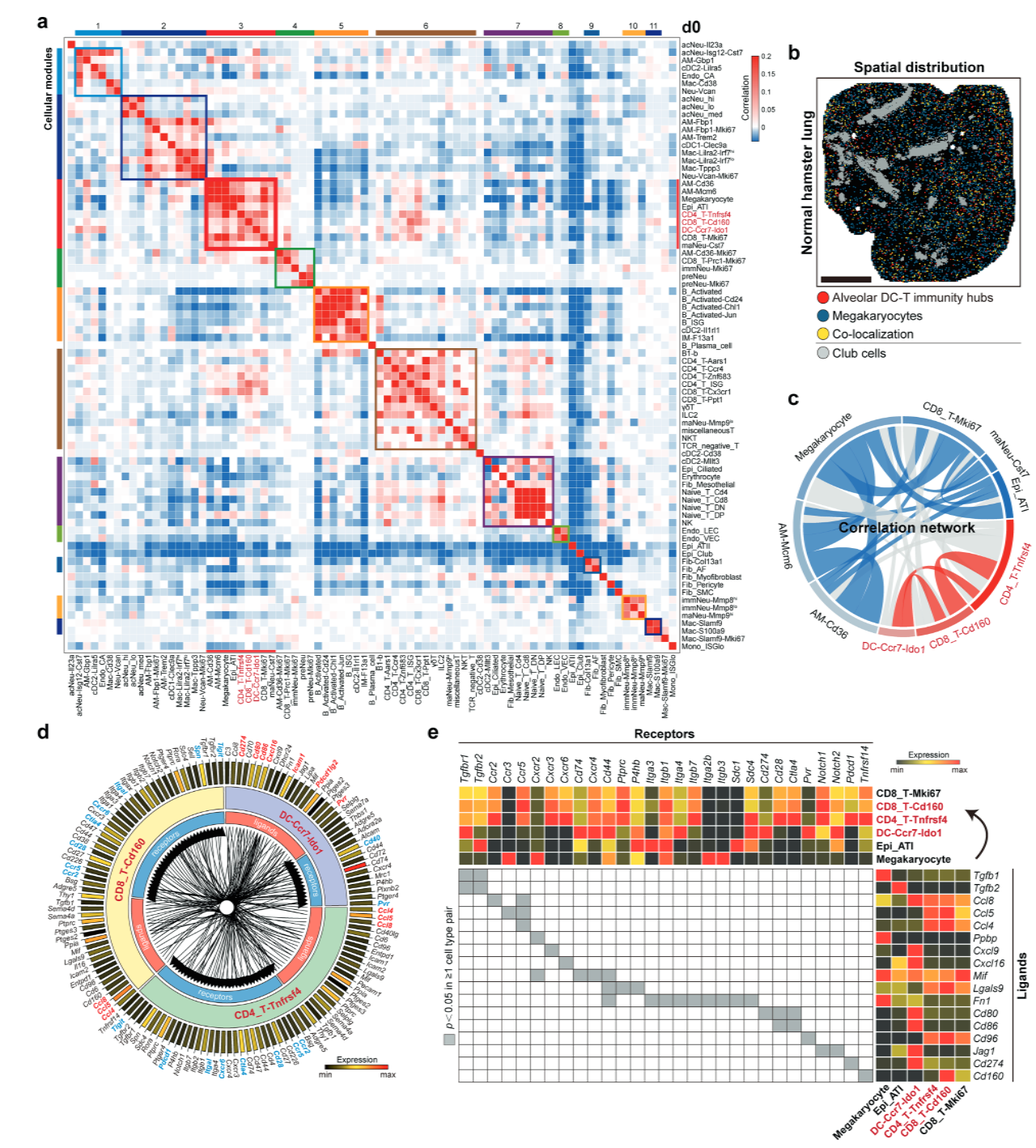
进一步的空间转录组分析揭示了SARS-CoV-2感染前后免疫和非免疫细胞的时空分布特征。研究发现了11个细胞模块(modules),其中模块3和模块5表现出类似淋巴结构的特征(图2a)。模块3主要由Ccr7+Ido1+树突状细胞、Cd160+Cd8+ T细胞、增殖中的Cd8+T细胞和Cd4+ T细胞亚群组成,具有肺泡定位特征。在SARS-CoV-2感染后,Cd160+Cd8+ T细胞和Tnfrsf4+Cd4+ T细胞数量显著增加,并在感染期间保持较强的共定位,被定义为稳定的DC-T免疫中枢(DC-T immunity hubs,图2d)。配体-受体分析显示,包括Slamf9+和S100a9+巨噬细胞在内的多种细胞类型参与了免疫中心的扩展。研究发现,Slamf9+巨噬细胞高表达Cxcl16、Cxcl11和Cxcl10,而Cd160+Cd8+ T细胞高表达相应的受体基因Cxcr6和Cxcr3,且这些配体-受体对在时空数据中被证实在空间上共表达。
研究人员进而通过免疫荧光染色验证了SARS-CoV-2感染前后hACE2小鼠肺组织切片中CD4、CD8、CD11c和CCR7的空间共定位结构的存在,提示了这种CD4+ T细胞、CD8+ T细胞和CCR7+DC的多细胞聚集结构在肺部免疫监视和快速响应肺部病毒感染中的作用。在病毒感染两周后,肺泡DC-T免疫中枢则又恢复了与生理状态类似的水平。此外,研究人员还验证了肺泡DC-T免疫中枢中的关键细胞亚群在SARS-CoV-2感染hACE2小鼠以及人类肺组织样本和COVID-19患者尸检样本scRNA-seq公开数据集中的存在,进一步证明了该研究的发现在肺部免疫防御机制中的广泛相关性。
总结来说,该研究揭示了DC-T免疫中枢作为预防性免疫区域的作用,能够快速响应并协调多种免疫细胞清除SARS-CoV-2感染。这些发现为理解病毒感染的免疫机制和开发抗病毒疗法提供了新的视角。
肺部的单细胞时空分析揭示了Slamf9+巨噬细胞在病毒清除和炎症消退中的作用
“Single-cell spatiotemporal analysis of the lungs reveals Slamf9+macrophages involved in viral clearance and inflammation resolution”文章中,作者重点探讨了巨噬细胞在病毒清除与炎症消退过程中的关键作用。
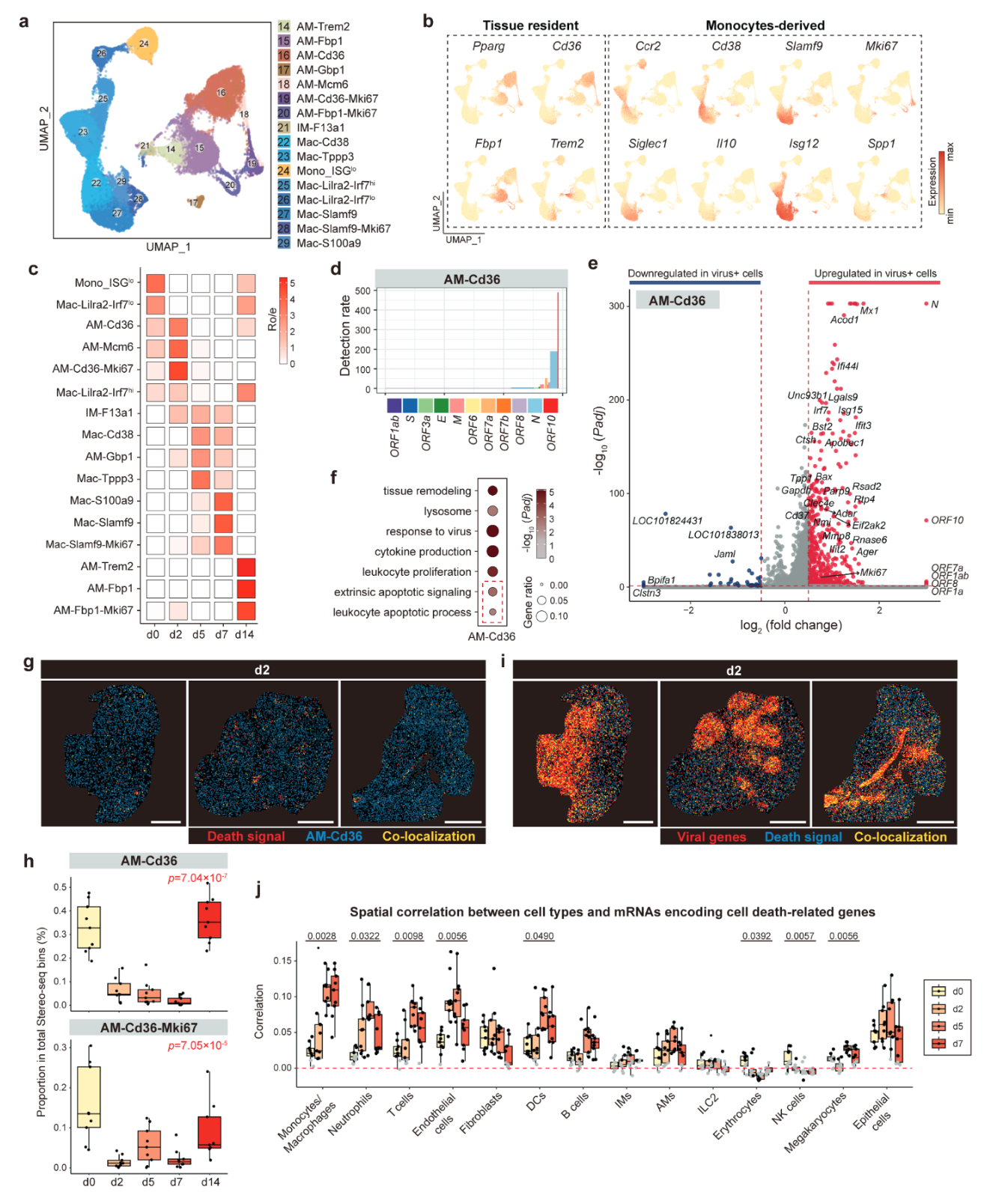
图3. SARS-CoV-2 感染在早期阶段导致大量肺驻留细胞死亡
研究表明,SARS-CoV-2感染对肺常驻巨噬细胞(alveolar macrophages, AMs)这一关键的先天免疫哨兵亚群造成了显著影响,并伴随了细胞死亡。空间转录组分析揭示,AMs、内皮细胞、中性粒细胞和单核细胞在感染的第2天(d2)与病毒基因高度共定位。其中,Marco+Mrc1+Pparg+Ccr2-的AM亚群(AM-Cd36,cluster 16)在感染前(d0)和急性期(d2)均富集(图3a-c),且病毒阳性细胞比例在d2达到50%,远高于上皮细胞的26%。该亚群展现了活跃的病毒亚基因组转录活性(图3d),显示病毒在此群体中高效复制。AM-Cd36感染过程中,抗病毒反应和细胞凋亡基因显著上调(图3e, f),但该群体在d2后迅速耗竭(图3g, h),且病毒基因与细胞死亡信号高度相关(图3i),表明病毒可能通过诱导巨噬细胞死亡削弱肺部防御。
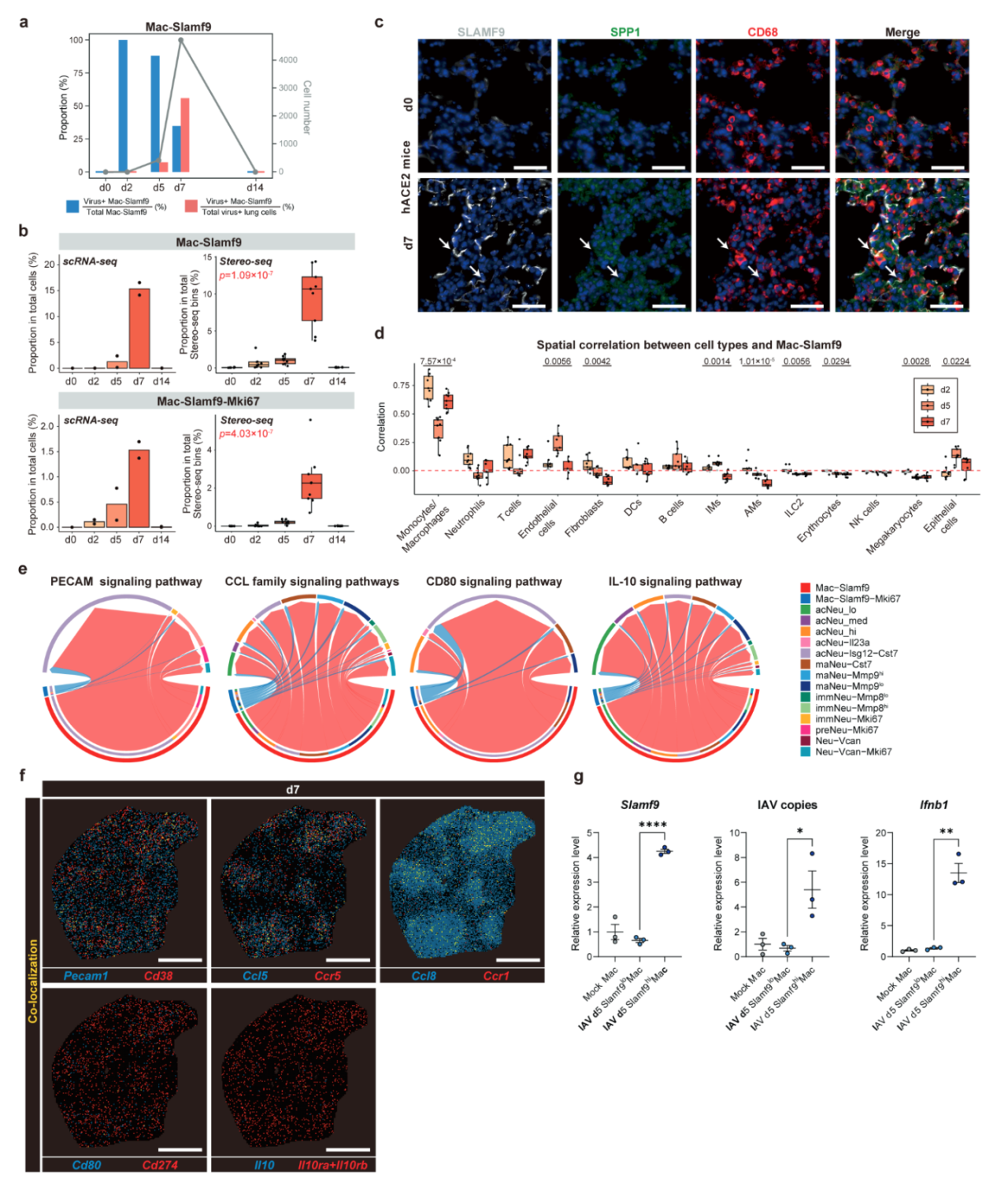
图4. SARS-CoV-2 诱导产生了Slamf9+巨噬细胞用于病毒清除
研究进一步发现,伴随病毒感染引发的组织损伤,肺部积累了两个SARS-CoV-2阳性率极高的巨噬细胞亚群:Cd38+巨噬细胞(Mac-Cd38,cluster 22)和Slamf9+巨噬细胞(Mac-Slamf9,cluster 27)。Slamf9+巨噬细胞在感染第5天(d5)仍保持88%的病毒RNA阳性率,占所有病毒阳性细胞的7.3%(图4a);在第7天(d7),该细胞亚群数量增加,占总病毒阳性细胞的56%,但阳性率下降至34.8%。这些巨噬细胞在感染后期上调了与组织重塑和血管内皮生长因子生成相关的基因,而非与细胞死亡相关的基因(图4b, c),暗示其具备抗细胞凋亡特性,并可能通过促进纤维化,在病毒清除和炎症消退中发挥作用。
空间分析还显示,从d2至d5,Slamf9+巨噬细胞与内皮细胞和上皮细胞的共定位增加(图4d),表明其可能被招募至受损区域。d5至d7期间,Slamf9+巨噬细胞周围的中性粒细胞数量显著增加(图4d)。研究还通过检测配体-受体基因的共表达(如Pecam1/Cd38、Ccl5/Ccr5、Ccl8/Ccr1、Cd80/Cd274和Il10/Il10ra+Il10rb),确认了Slamf9+巨噬细胞与不同中性粒细胞亚群的相互作用(图4e, f),表明其在中性粒细胞的招募和功能调控中发挥了重要作用。
值得注意的是,Isg12+Cst7+中性粒细胞表达Cd274和Il10rb,可能与激活的细胞毒性T细胞和Slamf9+巨噬细胞相互作用,共同在感染晚期建立有利于炎症消退的微环境。此外,Slamf9+巨噬细胞与DC-T免疫中枢共定位,可能在肺部的病毒清除中发挥协同作用。这些发现提示Slamf9+巨噬细胞与中性粒细胞协同参与炎症消退,并有助于抑制病毒感染。
研究进一步发现,在感染晚期,Trem2+和Fbp1+巨噬细胞逐渐在肺部富集,帮助促进炎症消退及肺泡巨噬细胞的补充。单细胞RNA测序和空间转录组数据显示,SARS-CoV-2的RNA在感染第14天几乎完全从金黄地鼠肺部消失。研究人员进一步探索了这些巨噬细胞的命运。由于Cd38+和Slamf9+巨噬细胞未表现出与细胞死亡相关的基因表达,作者通过CellRank分析发现Slamf9+巨噬细胞可能在炎症消退阶段分化为Trem2+和Fbp1+巨噬细胞。Trem2+细胞(与纤维化相关)和Fbp1+细胞(糖异生途径的关键酶)在第14天显著富集,但在健康对照组中缺失。RNA速度分析和轨迹分析揭示了AM-Trem2细胞逐渐向AM-Fbp1和组织驻留的AM-Cd36亚型转变的过程,伴随基因表达从炎症状态向稳态的过渡。Stereo-seq数据还表明,Fbp1+巨噬细胞与AMs共定位,提示其可能在巨噬细胞的补充过程中发挥作用。
这篇文章通过单细胞时空分析,全面揭示了SARS-CoV-2感染后的肺部免疫稳态动态变化,特别是Slamf9+巨噬细胞在病毒清除和炎症消退过程中的核心作用。这些研究成果不仅为理解SARS-CoV-2感染的免疫机制提供了新的见解,还为开发新的诊断、治疗及预防策略提供了重要启示。
综上所述,这两篇文章系统展示了SARS-CoV-2感染后金黄地鼠肺部的时空变化,深入刻画了病毒感染引发的组织损伤、免疫细胞浸润、病毒清除以及随后的炎症消退和组织修复的全过程。该研究为深入理解病毒性疾病的免疫机制提供了重要见解,也为开发新的抗病毒疗法和促进组织修复的策略奠定了坚实的理论基础。
南开大学曹雪涛院士、华大生命科学研究院汪建、刘龙奇,中国医学科学院秦川及北京昌平实验室任仙文为本文通讯作者。
论文链接:
https://www.nature.com/articles/s41421-024-00733-5
https://www.nature.com/articles/s41421-024-00734-4






