尽管氮气约占大气组成成分的78%,但植物对氮的利用却十分有限,因此在农业生产中需要施用大量的氮肥以维持作物的正常生长。农业绿色革命以来,氮肥主要来自化学生产。仅2022年,中国的氮肥施用量就超过1,654万吨。大规模的化肥施用,不仅浪费资源、增加成本,也带来一系列环境问题。一些固氮微生物能够将空气中的氮气转化为氨,这一过程称之为生物固氮。研究植物共生固氮的分子机制,能够有效提高共生固氮效率,对实现减肥增效、发展绿色农业具有重要意义。
固氮微生物依据固氮菌和植物的关系,可以分为自生固氮微生物、共生固氮微生物和联合固氮微生物三类。共生固氮微生物可以在植物器官(如根瘤)中利用宿主的光合产物作为能量来源,固定氮以支持宿主的生长。目前对植物共生固氮的研究,主要关注根瘤等固氮器官与微生物之间的信号传导和物质交换。使用单细胞和时空组学技术,能够更加细致地解析共生固氮机制。
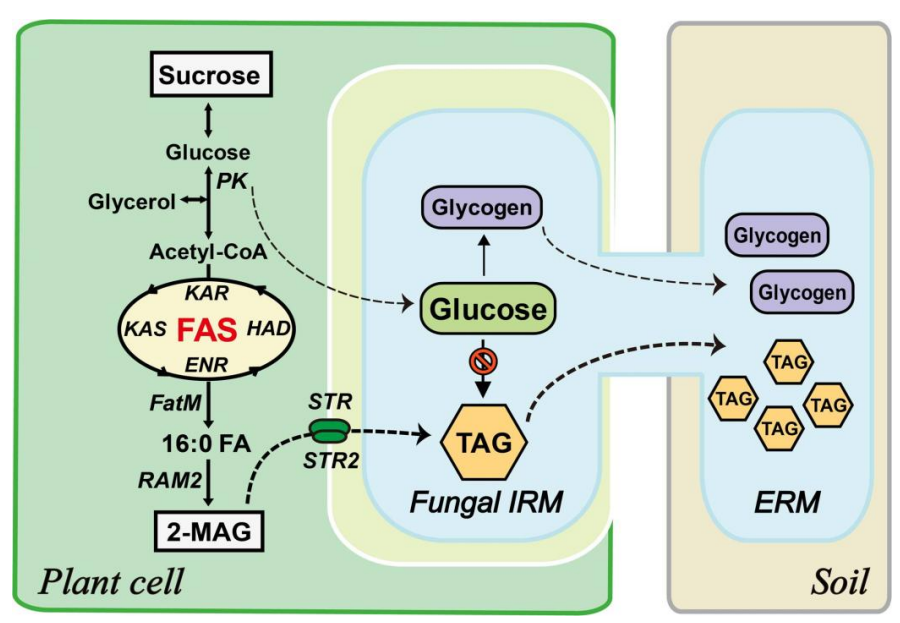
植物向共生菌转运脂肪酸的分子机制[1]
植物根瘤可分为不定型根瘤(如紫花苜蓿和豌豆的根瘤)和定型根瘤(如大豆和百脉根的根瘤)两类。其中不定型根瘤的顶端分生组织能够发育成结构复杂的圆柱形区域,该区域内部中心被细分为五个不同的功能区域,包括分生区、感染区、中间区、固定区和衰老区,每个区域的细胞功能各不相同。使用单细胞测序技术,可以从单细胞层面,原位解析根瘤内的高度异质性组织,阐释植物与固氮菌之间的共生机制,确定参与共生的关键基因和通路,包括信号传导,养分运输等。
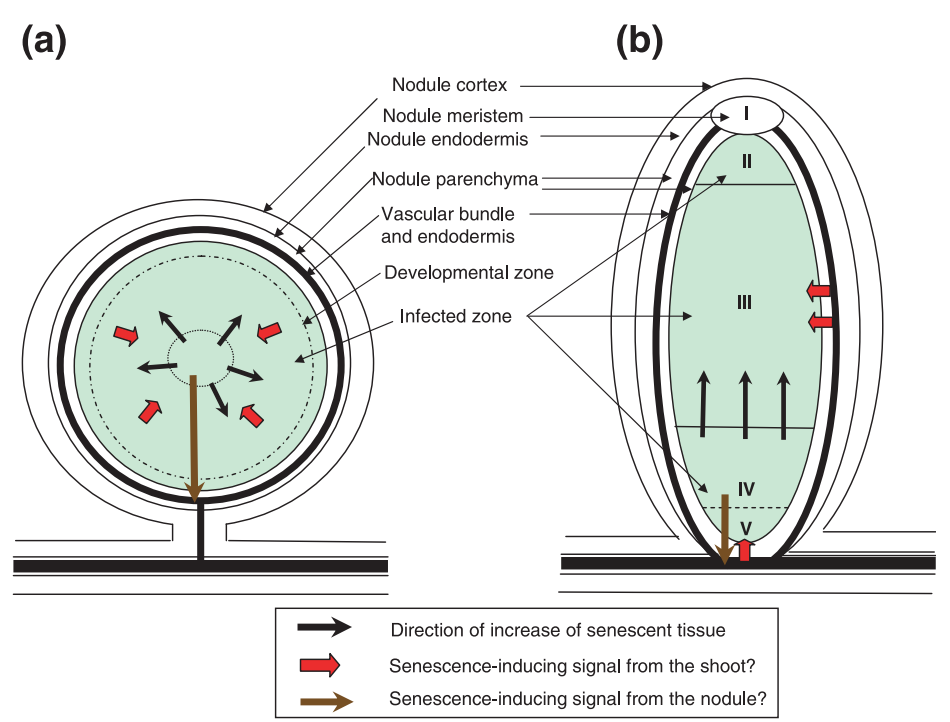
定型根瘤(a)和定型根瘤(b)的结构[2]
值得一提的是,华大推出的单细胞平台,以其高效能、高通量的特性,能够轻松获取植物组织中海量细胞的表达谱数据,为科学家们提供了一个强大工具,助力研究人员更深入地挖掘细胞亚群的特性与功能。
经典案例一 ▶ 单细胞技术解析蒺藜苜蓿根瘤内共生细胞的分化轨迹
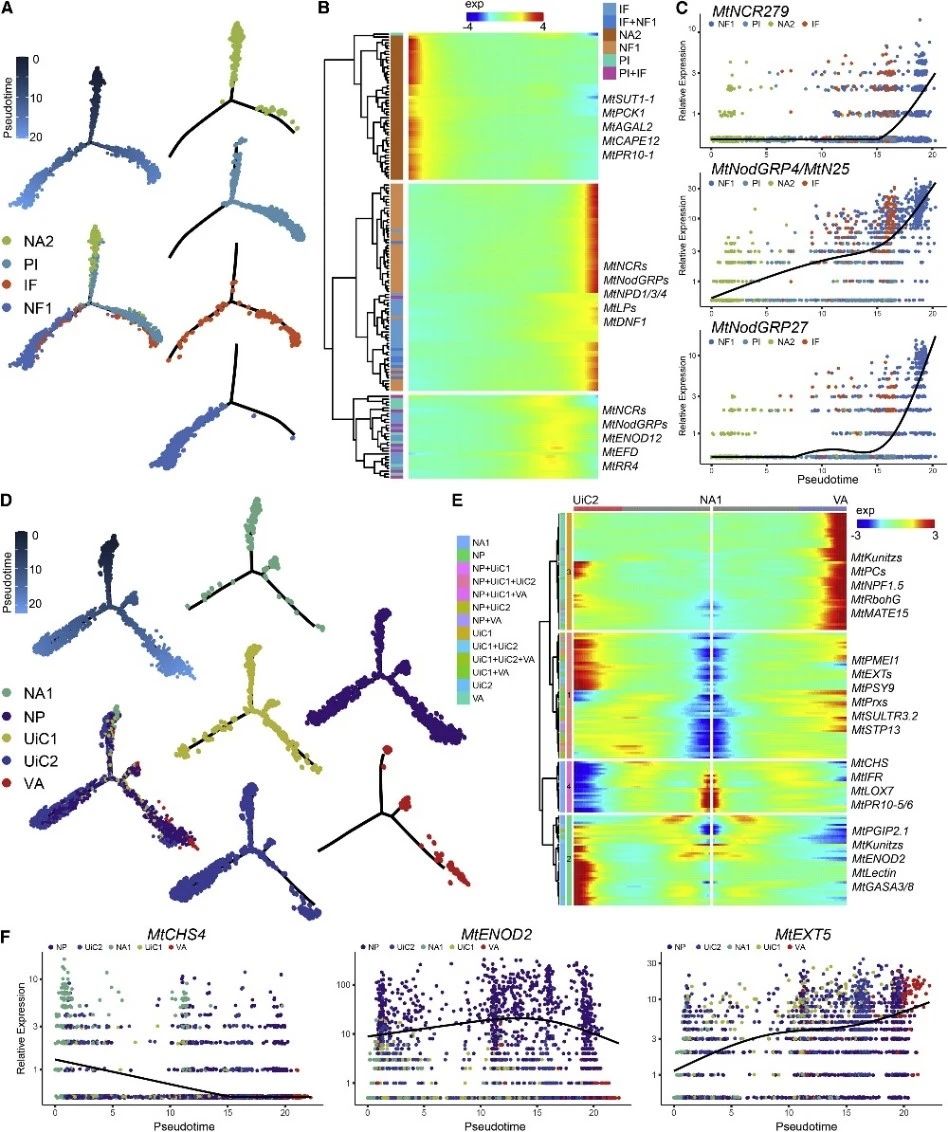
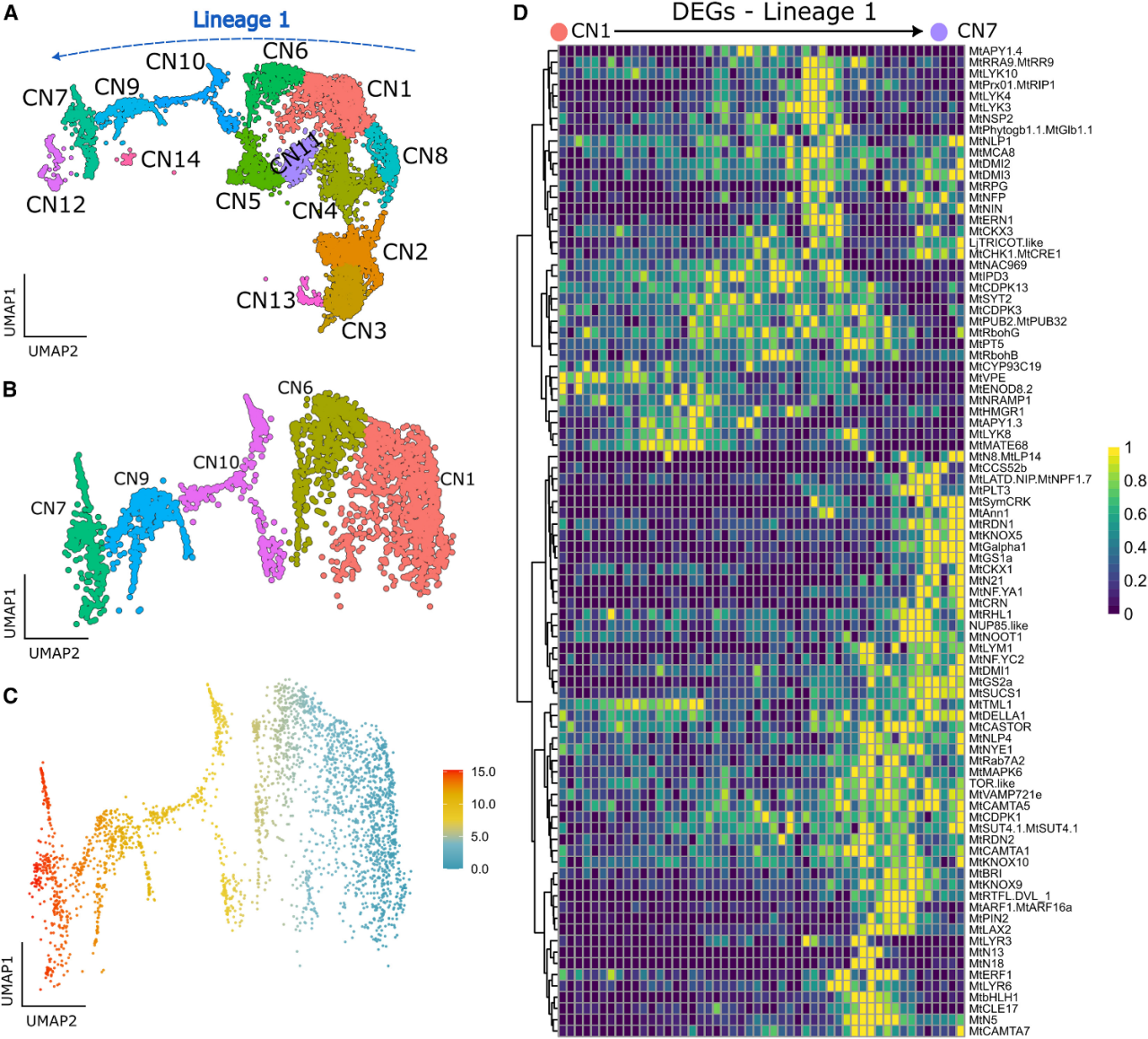
根瘤是一个复杂的共生固氮工厂,其中细胞高度异质性,但根瘤细胞的分化轨迹和相互联系仍不清楚。2022年,中国农业大学生物学院王涛教授研究团队建立了一种改进的根瘤原生质体制备方法,并对不定型苜蓿根瘤进行了单细胞测序分析,揭示了顶端分生细胞向共生和非共生根瘤细胞分化的细胞轨迹。
首先,研究人员利用改进后的根瘤原生质体制备方法,构建了蒺藜苜蓿根瘤细胞图谱。进一步通过GUS染色方法识别了这些细胞类型的空间分布模式。拟时序分析进一步发现两组顶端分生细胞沿着其特定的轨迹发育成共生和非共生命运细胞。对每个细胞簇的生物功能分析揭示了他们之间的转录异质性和相互作用关系,特别是发现未感染的固氮区细胞也通过进行天冬酰胺的合成参与氮同化。
经典案例二 ▶ 感染早期蒺藜苜蓿根细胞对根瘤菌的细胞反应
根瘤共生的建立需要两个过程的协调:根瘤菌感染和根瘤器官发生。第一个过程,当根毛细胞被根瘤菌感染时,根皮层细胞在感知共生信号后重新激活有丝分裂,形成根瘤原基。第二个过程中,新生的根瘤原基细胞发育成各种细胞类型。
2024年,Matias Kirst带领团队使用单细胞测序,捕获了细菌感染过程中,蒺藜苜蓿根的各细胞类型对根瘤菌感染的细胞反应,解析了皮层细胞向根瘤原基分化的细胞轨迹,鉴定调控这一过程的关键调控因子(包括STYLISH 4 等)作用。
植物根瘤是一个高度异质性的组织,借助空间转录组测序技术可以了解根瘤细胞的空间分布,鉴定根瘤成熟过程中的重要细胞亚群。进一步地,研究人员可以解析宿主与根瘤菌共生关系建立过程中的信号传导和物质交换机制,并探索共生机制的跨物种应用。
植物单细胞数据分析过程中的一个难点在于,用于注释不同组织/细胞类型的标记基因通常很少,细致的注释较为困难。空间转录组测序技术能够原位检测基因的表达水平,因此研究人员可以借助形态学和解剖学观察结果辅助注释。例如,在植物根瘤的空间转录组学分析过程中,研究人员可以借助根瘤的贴片染色结果,预先完成分生区、感染区等分区划分,之后结合表达数据完成细致注释。
华大自主研发的时空组学技术Stereo-seq具备高精度的空间解析能力,能够精确捕获固氮器官中各类细胞类型及其结构的空间信息。研究人员可以利用Stereo-seq更深入地理解固氮器官和固氮菌之间的复杂性和动态性,为固氮机制的解析和未来的跨物种应用提供科学依据。
经典案例三 ▶ 时空转录组学绘制百脉根根瘤器官发生的空间图谱
根瘤器官发生过程复杂,全面的转录组图谱对于揭示其中涉及的潜在生物学过程和功能基因至关重要。目前蒺藜苜蓿不定型根瘤已经有一些研究,但对定型根瘤的研究仍然较为匮乏。
2024年,中国农业科学院深圳农业基因组研究所联合华大生命科学研究院等机构,基于华大自主研发的时空组学技术Stereo-seq深入研究了百脉根(Lotus japonicus)定型根瘤的发育,描绘了感染区和外周组织的发育轨迹,揭示了在每个阶段发挥作用的基因。特别的是,该研究发现了LjNLP3(NIN-LIKE PROTEIN 3)在根瘤从分化到成熟的转变中的作用,揭示这个基因家族在结瘤发育中的重要作用。
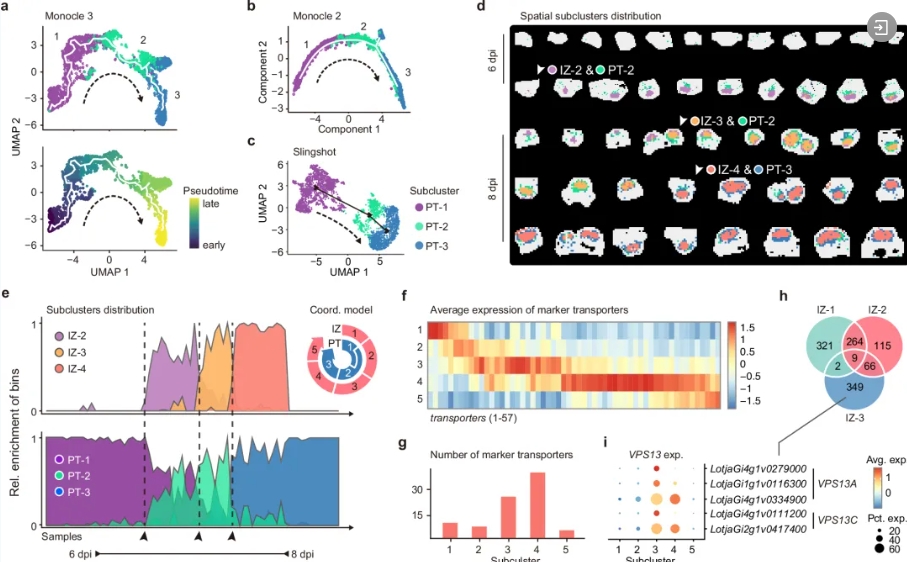
周围组织和感染区在定型根瘤中的协调分化[5]
经典案例四 ▶ 空间单细胞联合分析鉴定大豆根瘤成熟过程中的过渡细胞亚型
根瘤菌能够感染兼容的宿主植物,并在根部形成共生的固氮根瘤,固定大气中的氮转化为有机氮,供宿主植物发育。尽管目前在根瘤发育和共生信号传导领域有了显著的进展,但对不同细胞类型的在根瘤中的具体贡献以及它们在根瘤成熟过程中的关系的了解仍然有限,尤其是在定型根瘤中。
2023年,南方科技大学翟继先课题组与中国农业科学院作物科学研究所大豆优异基因资源发掘与创新利用创新团队阎哲研究员合作,应用snRNA-seq,以及包括华大自主研发的Stereo-seq在内的空间转录组学技术,构建了大豆根瘤和根的空间分辨单细胞核转录组图谱,揭示了大豆根瘤成熟过程中基因表达的动态变化,并在未成熟的根瘤侵染细胞中鉴定出一组参与根瘤成熟和根瘤固氮的过渡性细胞亚型,这为理解根瘤菌-豆科植物共生提供了新视角。
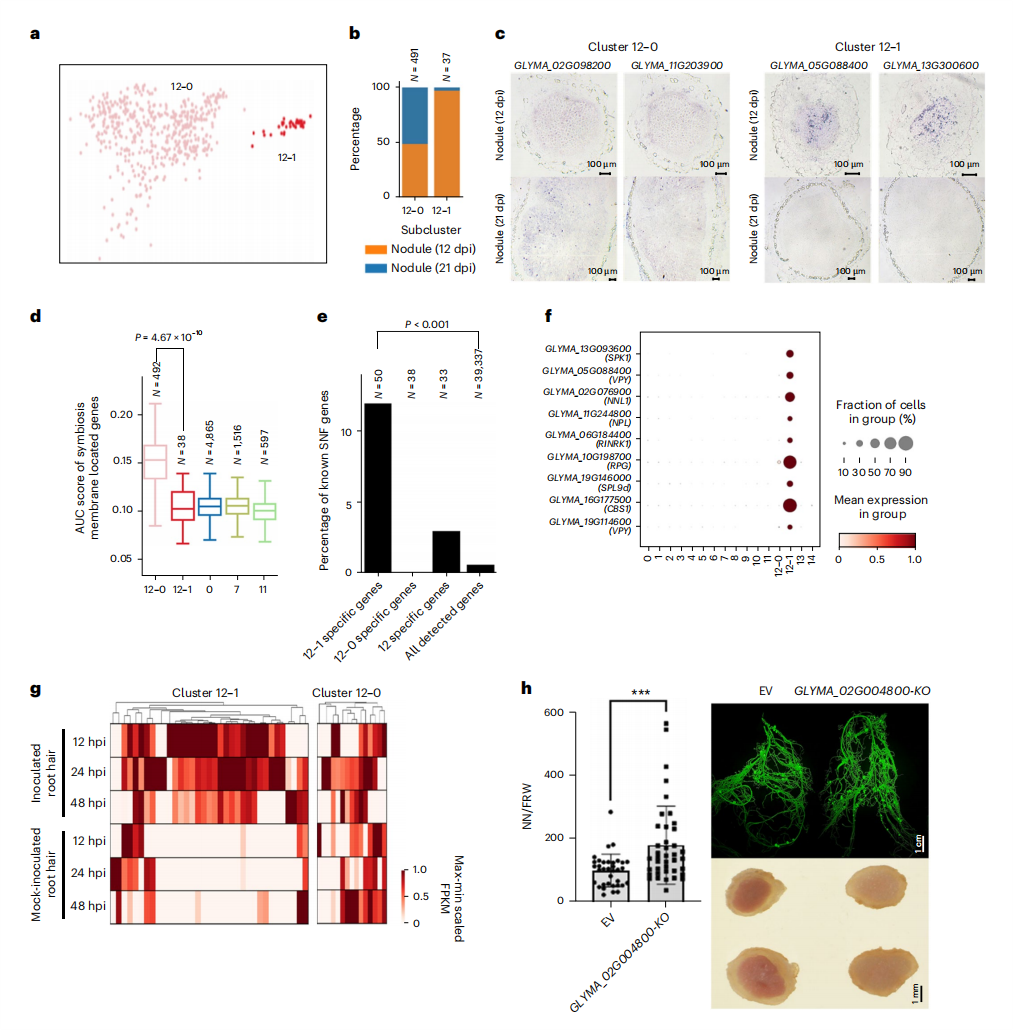
感染细胞的过渡亚型在根瘤成熟过程中的重要作用[6]
单细胞和空间转录组学技术已经在植物生长发育、愈伤再生、逆境胁迫以及共生固氮等领域得到广泛的应用。这些技术能够实现在单细胞水平上研究植物组织的转录模式,解析特点发育时期或特定组织的细胞组。
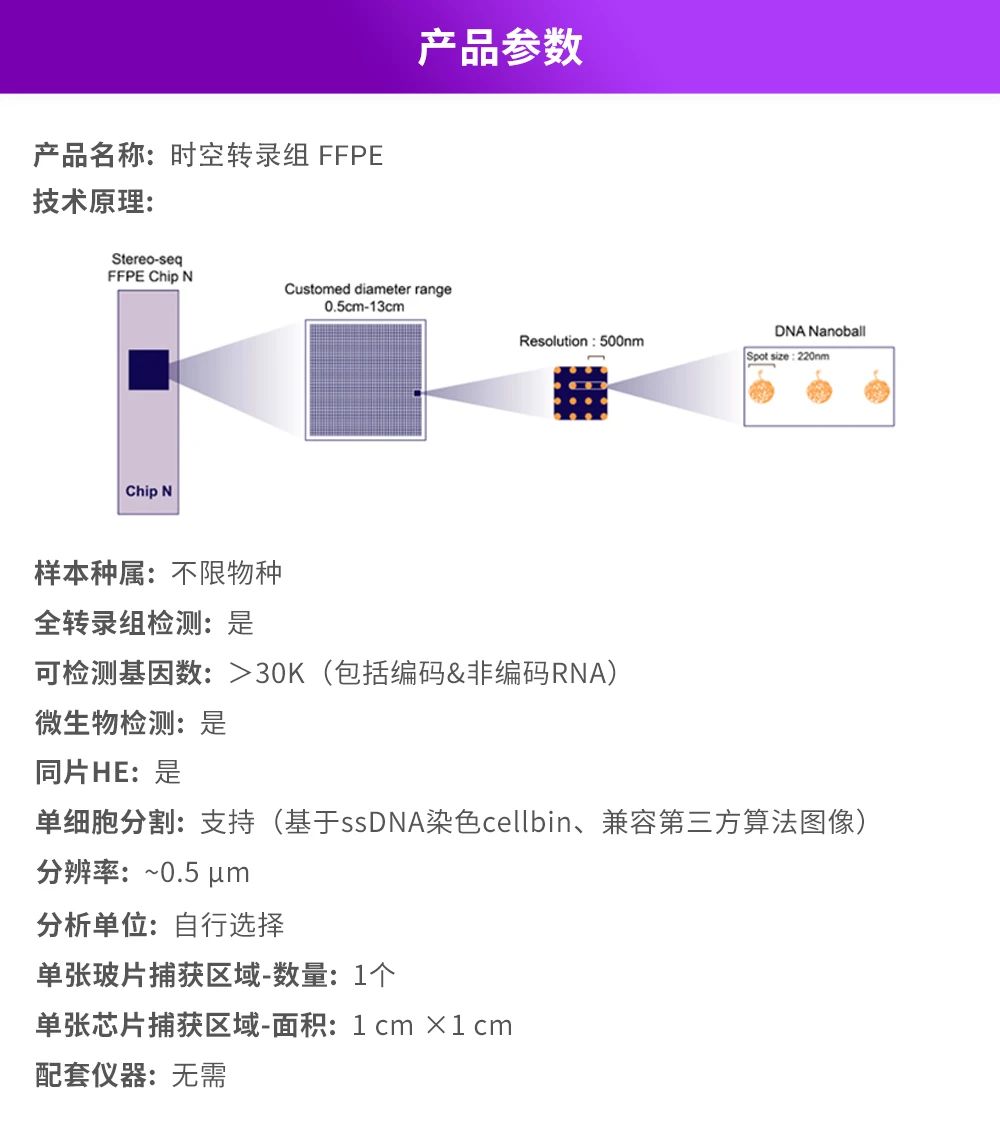
华大时空组学技术Stereo-seq是研究高分辨率空间多组学数据的前沿技术。基于Stereo-seq开发的时空转录组FFPE产品方案可提供单细胞分辨率的Total RNA空间信息。该方案利用“随机探针”对FFPE样本中组织细胞内的Total RNA分子进行原位捕获,并通过空间条形码(Coordinate ID,CID)还原回空间位置,实现全物种、全转录组空间表达图谱的构建。时空转录组FFPE以其独特的随机探针技术和卓越的性能,不仅能捕获宿主RNA,还能捕获微生物RNA,揭示微生物与宿主之间的互作关系,为深入探索宿主与微生物的相互机制提供了强大工具。
时空转录组FFPE产品亮点

▶ 宿主和微生物共检测:可同时捕获微生物及其宿主的空间表达信息,进而探究宿主与微生物的互作关系。
▶ 实现同张切片H&E染色:在同一张FFPE切片上兼容时空转录组分析和H&E染色,可进行多模态数据分析及探索。
▶ 编码及非编码RNA共捕获:基于随机探针的技术原理,可同时实现 mRNA 和 non-coding RNA的原位捕获。
▶ 无物种限制:不仅可以应用于人和小鼠,也可对其他物种进行时空组学信息挖掘。
▶ 纳米级分辨率:检测分辨率达到500 nm,可实现空间单细胞水平分析。
1. Jiang Y, Wang W, Xie Q, et al. Plants transfer lipids to sustain colonization by mutualistic mycorrhizal and parasitic fungi. Science. 2017;356(6343):1172-1175.
2. A, Groten K, Bastian F, et al. Legume nodule senescence: roles for redox and hormone signalling in the orchestration of the natural aging process. New Phytologist. 2005;165(3):683-701.
3. Ye Q., Zhu F., Sun F., Wang T.-C., Wu J., Liu P., Shen C., Dong J., and Wang T. Differentiation trajectories and biofunctions of symbiotic and un-symbiotic fate cells in root nodules of Medicago truncatula. Mol. Plant. 2022;S1674-2052(22)00371-9
4. Pereira WJ, Boyd J, Conde D, et al. The single-cell transcriptome program of nodule development cellular lineages in Medicago truncatula. Cell Reports. 2024;43(2):113747.
5. Ye, K., Bu, F., Zhong, L. et al. Mapping the molecular landscape of Lotus japonicus nodule organogenesis through spatiotemporal transcriptomics. Nat Commun 15, 6387 (2024).
6. Liu Z, Kong X, Long Y, et al. Integrated single-nucleus and spatial transcriptomics captures transitional states in soybean nodule maturation. Nat Plants. 2023;9(4):515-524.
内容 | 廖珣
审核 | 赵芳、张嘉琦、黎晓玲、廖上峰










