癌症是全球人类面临的巨大医学难题,每年新增的癌症患者高达2千万。肿瘤转移是造成约90%癌症患者死亡的原因,这一比例在几十年来几乎没有变化。肿瘤转移是一个非常复杂的生物学过程,涉及一系列连续且相互关联的步骤,如脱离原发肿瘤、渗入循环和淋巴系统、逃避免疫攻击、渗出远端毛细血管、侵入远端器官并存活增殖等过程。
在进行肿瘤转移相关研究时,为了探索转移过程中复杂的生物学过程,需要从单细胞、组织、患者等多角度对肿瘤转移进行理解。单细胞和时空组学技术的联合应用,能够获得高分辨率的海量数据,帮助研究者们捕捉癌症转移过程中细胞的动态变化。
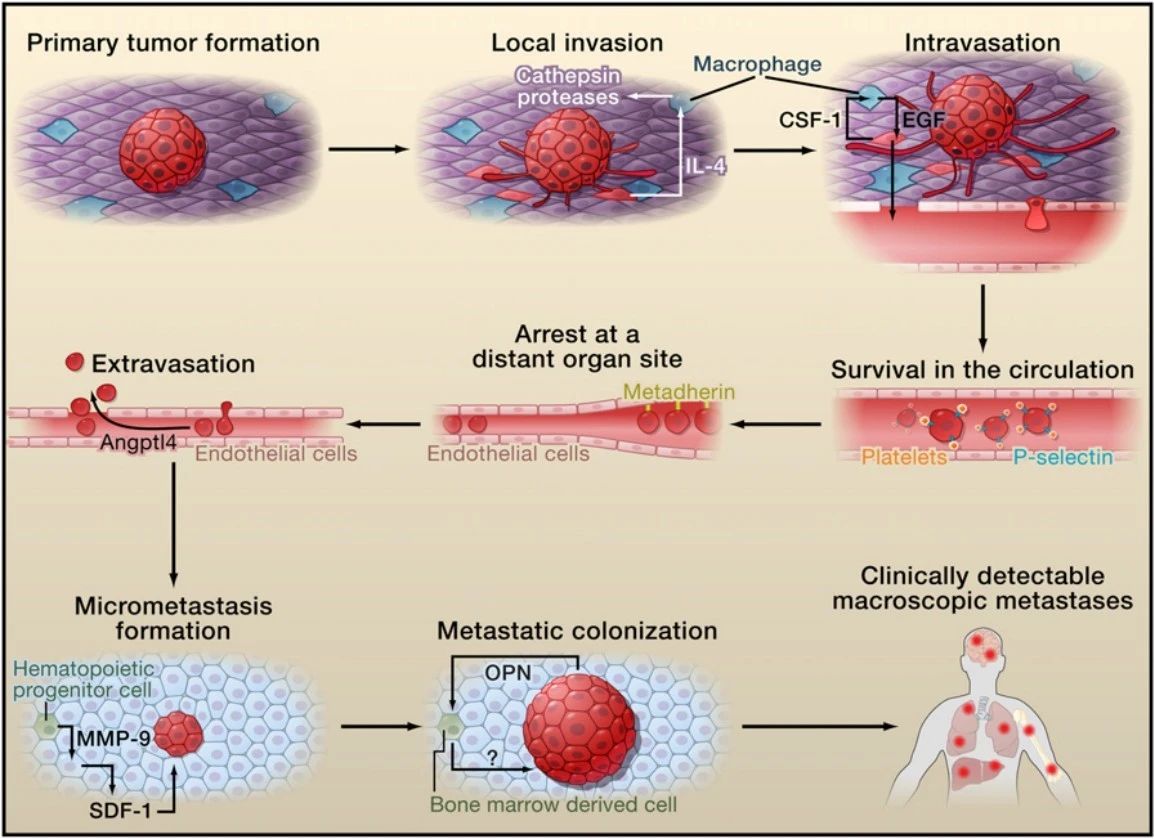
肿瘤转移级联模式图[1]
解析细胞亚群在肿瘤转移研究中的核心意义不容忽视,它构成了深入理解肿瘤复杂生物学特性的关键桥梁。肿瘤,这一由多细胞构成的动态生态系统,涵盖了肿瘤细胞、免疫细胞、基质细胞等多元参与者,它们之间的精妙互动深刻影响着肿瘤的发展轨迹、侵袭能力及转移策略。通过精细剖析这些细胞亚群,科学家们得以窥见肿瘤如何精妙地逃避免疫监控,如何灵活适应并重塑其微环境以加速生长与扩散的奥秘。
随着研究的深化,细胞亚群的深入解析不仅极大地拓宽了我们对肿瘤转移机制的认识边界,更为癌症的早期精准诊断、治疗抵抗性的破解以及创新疗法的研发铺设了坚实的科学基石。在这一探索过程中,单细胞RNA测序技术以其独特的优势崭露头角,它能在单个细胞层面上绘制出详尽的基因表达图谱,从而精准刻画细胞间的异质性,揭示隐藏在细胞多样性背后的生物学故事。
值得一提的是,华大推出的单细胞平台,以其高效能、高通量的特性,能够轻松获取肿瘤组织中海量细胞的表达谱数据,为研究人员提供了一个强大工具,更深入地挖掘细胞亚群的特性与功能。
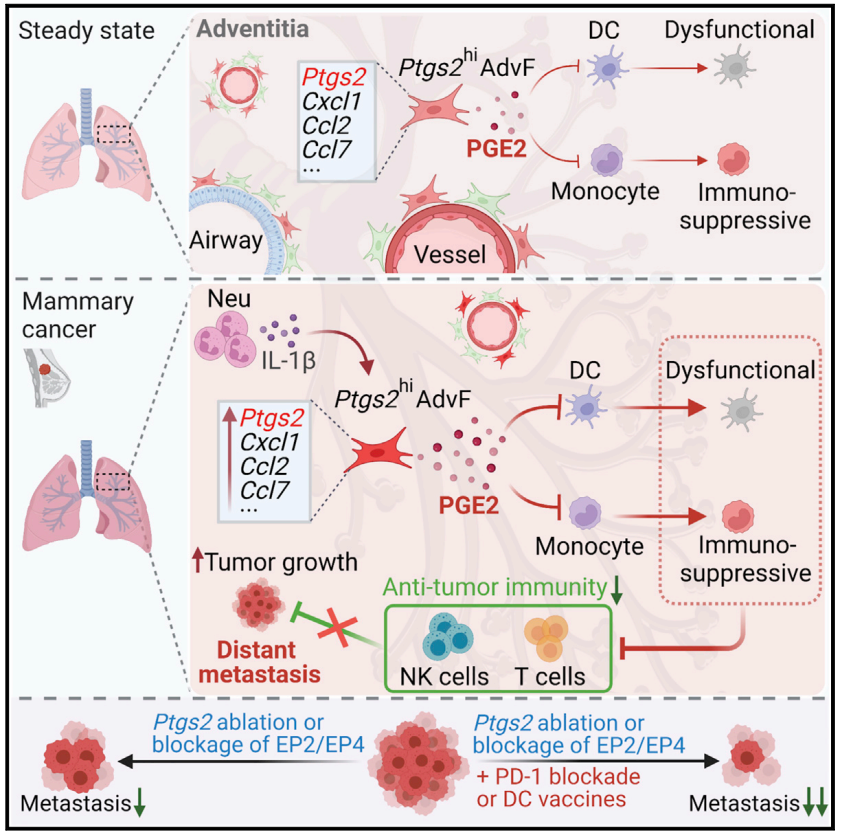
经典案例一 ▶ 解析影响乳腺癌肺转移的关键细胞亚群
在肿瘤转移研究中,原发肿瘤如何驱动前转移生态位的形成已经被广泛研究,但次级器官在协调转移扩散中的作用仍然模糊。2022年,美国杰克逊实验室任光文教授团队利用单细胞RNA测序技术详细解析了乳腺癌肺转移过程。
研究人员发现了一群表达环氧化酶2(COX-2)的外膜成纤维细胞,它们通过产生PGE2来调节免疫微环境,从而影响转移细胞在肺部的定植和生长。通过靶向COX-2或其产物PGE2 的信号通路,可能为减少乳腺癌肺转移提供了新的治疗策略。
空间信息为肿瘤转移研究提供了多维度的深入洞察,它帮助我们更清晰地理解肿瘤的异质性、细胞亚群的动态变化、免疫反应以及肿瘤微环境中细胞间的相互作用。通过精确解析细胞组织在空间中的位置能够明确不同细胞类型和细胞亚群在肿瘤微环境中的具体分布,这对于揭示肿瘤转移的机制具有至关重要的作用。
与单细胞RNA测序技术相比,空间转录组学技术更加注重将基因表达数据与细胞在组织中的空间位置信息相结合。该技术使得研究人员能够直接观察到不同细胞类型在肿瘤微环境中的空间分布模式,以及它们之间可能存在的相互作用关系。空间转录组学技术的应用,极大地丰富了我们对肿瘤微环境的理解,为肿瘤转移机制的探索提供了新的视角和工具。
华大自主研发的时空组学技术Stereo-seq具备高精度的空间解析能力,能够精确捕获肿瘤组织中各类细胞类型及其结构的空间信息。研究人员可以利用Stereo-seq更深入地理解肿瘤微环境的复杂性和动态性,为肿瘤的早期诊断、治疗策略的优化以及新疗法的开发提供有力的科学依据。
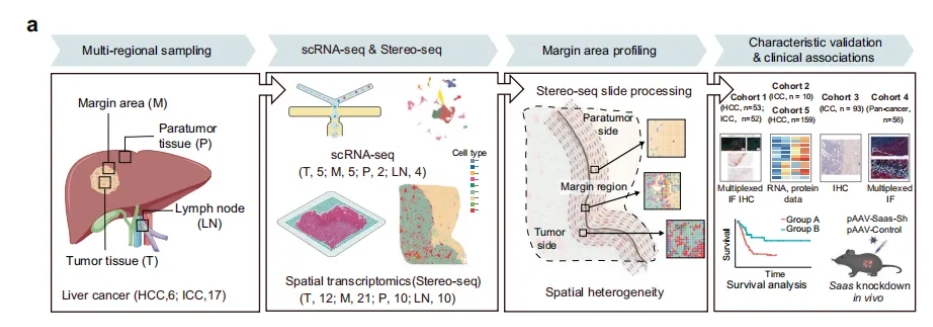
剖析和了解癌症生态系统,尤其是肿瘤边缘周围的生态系统,对肿瘤细胞浸润和侵袭具有重要意义,对于探索肿瘤转移机制和开发有效的新疗法至关重要。2023年,上海复旦大学附属中山医院与华大集团共建的“中华精准医学中心”、华大生命科学研究院和复旦大学附属中山医院等单位合作,利用华大自主研发的时空组学技术Stereo-seq系统研究了肝癌中的侵袭区,并解析了其中的肿瘤微环境特征。
他们在该区域发现了一群处于受损状态的肝细胞亚群,其血清淀粉样蛋白(SAA)表达增加,位于肿瘤旁侧的边界附近。CXCL6在恶性细胞中的过度表达可诱导附近肝细胞中JAK-STAT3通路的激活,导致这些肝细胞中SAA的过度表达。此外,肝细胞在侵袭区过度表达和分泌SAA可导致巨噬细胞募集和M2极化,进一步促进局部免疫抑制,可能导致肿瘤进展。在另外五个独立的原发性和继发性肝癌患者队列(n=423)中进行的临床关联分析表明,侵袭区SAA过度表达的患者预后较差。使用小鼠肝肿瘤模型进行的进一步体内实验证实,敲低肝细胞中编码SAA的基因可减少肿瘤边界周围的巨噬细胞积聚并延缓肿瘤生长。
03 单细胞+时空组学联合分析追踪肿瘤进展过程和深度挖掘肿瘤潜在治疗靶点
在肿瘤学研究的领域中,单细胞RNA测序和空间转录组学技术的联合应用逐渐成为推动肿瘤转移机制研究的重要力量,能够实现从细胞异质性解析到细胞空间分布定位的全面飞跃。单细胞RNA测序以其对基因表达的高精度检测,弥补了传统方法在细胞水平分析上的不足;而空间转录组学技术则通过保留细胞位置信息,克服了单细胞测序在空间解析上的局限。两者的融合,为科研人员绘制了一幅既精确又全面的肿瘤微环境动态图谱。
在转移性肿瘤研究中,这种联合分析策略对于发现潜在治疗靶点具有巨大价值。它不仅促进了对癌症分子机制的理解,还指导了新药研发的方向,推动了个性化和精准医疗的发展。通过综合多组学数据,科学家能够深入分析肿瘤微环境的变化,探索免疫治疗的潜力,为肿瘤治疗领域带来新的突破。
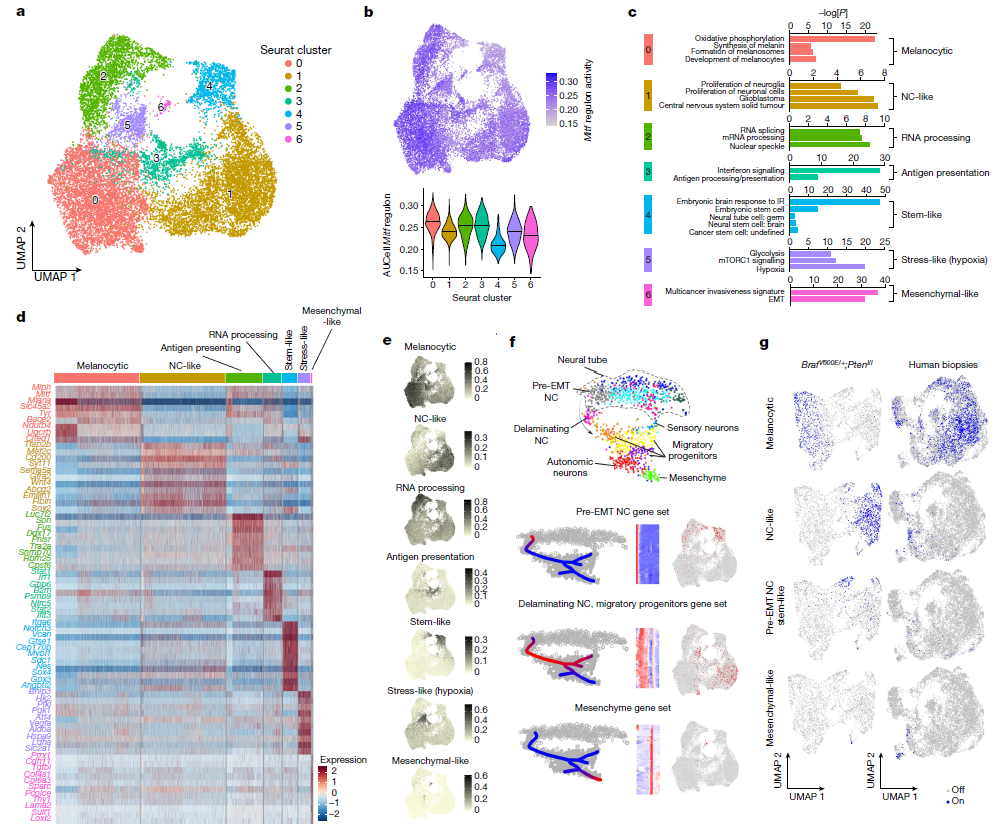
黑色素瘤因其高度的异质性和可塑性而臭名昭著,我们对细胞状态多样性的起源和模式仍然知之甚少。同时,对于其生长和转移是否由不同的黑色素瘤亚群支持也尚未明确。2022年,比利时鲁汶VIB癌症生物学中心的研究人员,利用包括华大Stereo-seq等在内的scRNA-seq、空间转录组测序联合分析方法,在黑色素瘤中鉴定出一群数量有限但能有效支持肿瘤生长的致瘤细胞群,为开发黑色素瘤的早期检测以及制定治疗措施提供帮助。
研究人员发现肿瘤细胞的成瘤能力与空间局部的血管周围生态位有关,这种能力通过与内皮细胞建立的细胞间通讯而产生。对具有间充质样状态的黑色素瘤细胞群进行时间单细胞追踪表明,这些细胞不会促进原发性肿瘤生长,而是构成一个转移性起始细胞池,这些细胞在扩散到次级器官时会转换细胞身份。该研究提供了黑色素瘤细胞状态多样性和轨迹的时空图谱,并表明具有生长和转移能力的肿瘤细胞来自于不同的细胞亚群,这些表型能力可以在暴露于特定的生态位信号后动态获得,这一观察结果为开发干扰此类微环境提供了数据和理论基础。
晚期宫颈癌的有效治疗仍然是一个非常大的医学挑战。2022年,深圳华大生命科学研究院与华中科技大学医学院附属同济医院、重庆西南医院,联合利用单细胞RNA测序 (snRNA-seq) 和时空组学技术 (Stereo-seq) 研究宫颈鳞状细胞癌 (CSCC) 的免疫微环境。
研究人员发现,除LGALS9和IDO1外,CSCC肿瘤和炎症区域中大多数免疫抑制基因的表达水平没有显著高于非癌症样本中的表达水平。他们在高代谢水平的肿瘤区域中发现了更强的 CD56+ NK细胞和未成熟树突状细胞信号,而在低代谢水平肿瘤区域中发现了更多的嗜酸性粒细胞、未成熟B细胞和Treg细胞。同时,他们还发现了一簇促肿瘤发生的成纤维细胞,这些成纤维细胞可能通过抑制淋巴细胞浸润和肿瘤细胞外基质的重塑来支持肿瘤的生长和转移。此外,这些成纤维细胞与患者的更差的预后有关,因此可以用于预测患者对免疫疗法的耐药性。这些发现增强了对CSCC免疫微环境的理解,并为晚期CSCC的治疗提供了启示。
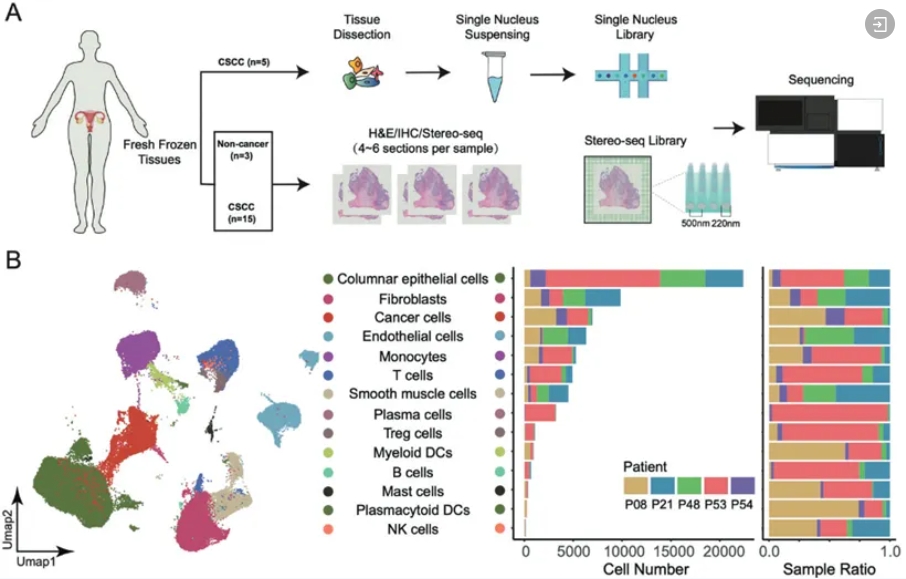
时空多组学挖掘宫颈癌免疫微环境及其潜在治疗靶点[5]
单细胞和空间转录组学技术逐渐成为肿瘤研究的关键,有助于深入分析肿瘤微环境的复杂性和动态变化、发现新治疗靶点并推动个性化医疗。这些技术将帮助我们更好地理解肿瘤,为早期诊断和治疗提供支持。
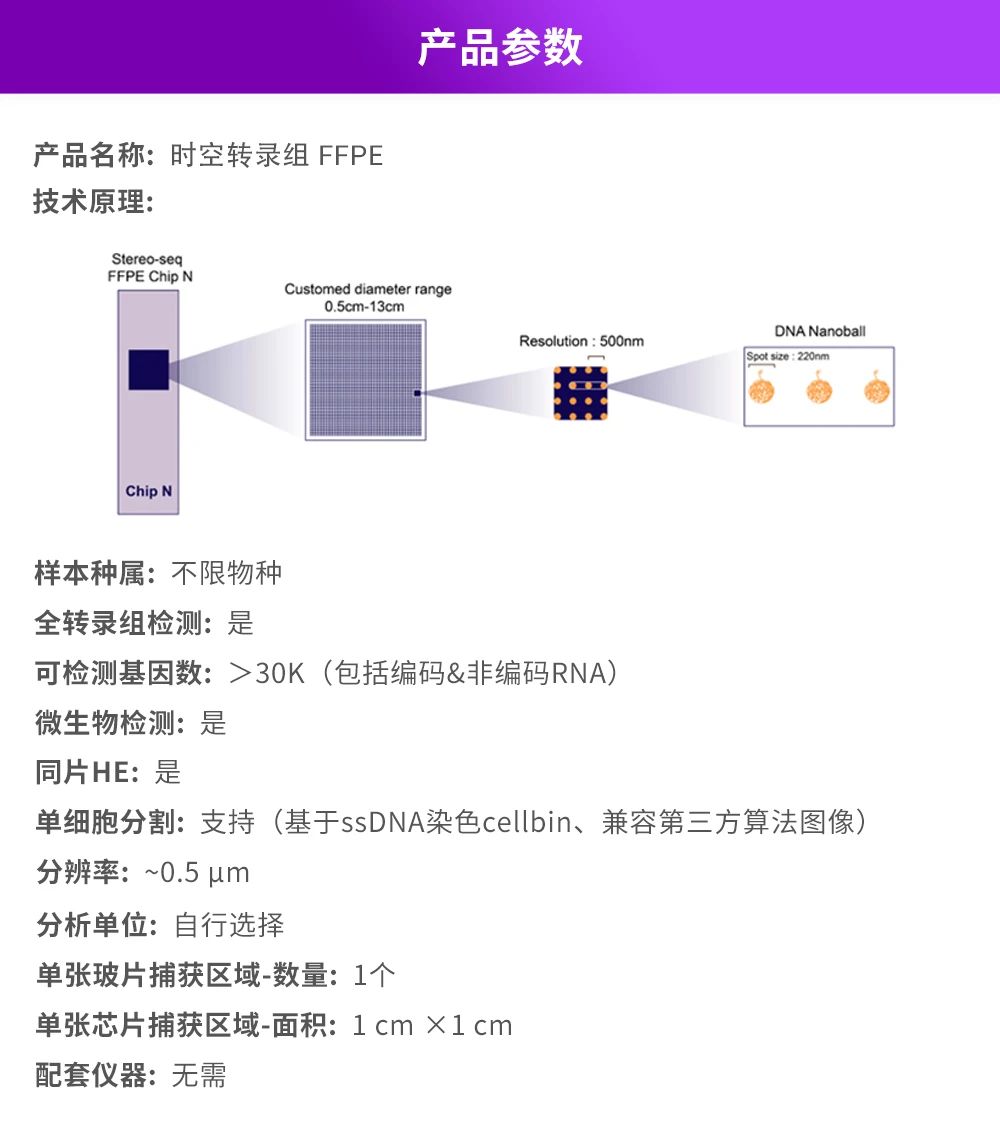
华大时空组学技术Stereo-seq是研究高分辨率空间多组学数据的前沿技术。华大时空推出的时空转录组FFPE产品方案基于全新探针设计,可提供单细胞分辨率的Total RNA空间信息,旨在深入探索与临床病理机制相关的发现,为发现深层机制、药物靶点和新的治疗策略提供新工具。
该方案利用“随机探针”对FFPE样本中组织细胞内的Total RNA分子进行原位捕获,并通过空间条形码(Coordinate ID,CID)还原回空间位置,实现全物种、全转录组空间表达图谱的构建,助力临床科研深入理解疾病的发生与发展机制。
▶ 宿主和微生物共检测
可同时捕获微生物及其宿主的空间表达信息,进而探究宿主与微生物的互作关系。
▶ 实现同张切片H&E染色
在同一张FFPE切片上兼容时空转录组分析和H&E染色,可进行多模态数据分析及探索。
▶ 编码及非编码RNA共捕获
基于随机探针的技术原理,可同时实现 mRNA 和 non-coding RNA的原位捕获。
▶ 无物种限制
不仅可以应用于人和小鼠,也可对其他物种进行时空组学信息挖掘。
▶ 纳米级分辨率
检测分辨率达到500 nm,可实现空间单细胞水平分析。
1. Valastyan S, Weinberg R A. Tumor metastasis: molecular insights and evolving paradigms[J]. Cell, 2011, 147(2): 275-292.
2. Gong, Zheng et al. “Lung fibroblasts facilitate pre-metastatic niche formation by remodeling the local immune microenvironment.” Immunity vol. 55,8 (2022): 1483-1500.e9.
3. Wu, Liang et al. “An invasive zone in human liver cancer identified by Stereo-seq promotes hepatocyte-tumor cell crosstalk, local immunosuppression and tumor progression.” Cell research vol. 33,8 (2023): 585-603.
4. Karras, P. et al. A cellular hierarchy in melanoma uncouples growth and metastasis. Nature 610, 190–198 (2022).
5. Ou, Zhihua et al. “Single-Nucleus RNA Sequencing and Spatial Transcriptomics Reveal the Immunological Microenvironment of Cervical Squamous Cell Carcinoma.” Advanced science (Weinheim, Baden-Wurttemberg, Germany) vol. 9,29 (2022): e2203040.










