2024年5月,华大时空组学技术Stereo-seq助力中国科学家首次3D重构了原肠胚完整模型,并在Cell发表,该研究成果近期也入选了Cell 2024年度最佳论文(Best of 2024)特辑。
近日,Stereo-seq再度助力研究人员在该领域取得重要进展。中国科学院动物研究所郭靖涛研究员、中国农业大学魏育蕾教授、北京理工大学肖振宇副教授及中国科学院动物研究所于乐谦研究员再次合作,于Nature Cell Biology上发表成果(DOI: 10.1038/s41556-024-01597-3),利用高分辨Stereo-seq的连续切片,结合深度学习算法进行三维对齐,生成了包含不同细胞类型和基因表达的三维空间分布点云图,从而数字3D重构了CS7时期的原肠胚模型。

华大时空组学国内首家生态合作伙伴安诺优达为本研究提供了Stereo-seq实验和技术支持。
原肠胚的形成是哺乳动物胚胎发育的关键点,它决定了细胞迁移、定位和分化的精确性,进而形成正常的多胚层结构及器官系统。因此,研究早期原肠运动的分子规律对理解胚胎发育机制至关重要。目前,早期原肠胚形成的研究相对较少,且缺乏空间信息。尽管已通过3D重构研究了CS8时期的胚胎及关键事件,但许多早期原肠胚事件,如前后轴建立和原始生殖细胞特化,已在更早的CS7阶段便发生。因此,对CS7阶段进行空间转录组研究,旨在深入了解早期原肠作用的空间、细胞和分子特征。
对CS7时期胚胎“从前至后”进行82张连续冷冻切片,并进行Stereo-seq高分辨率空间转录组实验,数字重建胚胎的三维模型。
01 CS7原肠胚的空间特征
通过82张空间转录组信息共得到28,804个spots/cells,每个spots平均捕获4,210个UMI及1,603个基因。通过聚类分析,共获得11个主要细胞亚群。研究人员基于转录组相似性和空间信息构建了CS7的三维模型,以阐释沿前后轴(AP)或背腹轴(DV)分布的细胞亚群情况。其中,脊索、原条和体蒂沿AP轴分布,羊膜和外胚层定位于背侧,以及定形/内脏内胚层和卵黄囊内胚层位于腹侧。
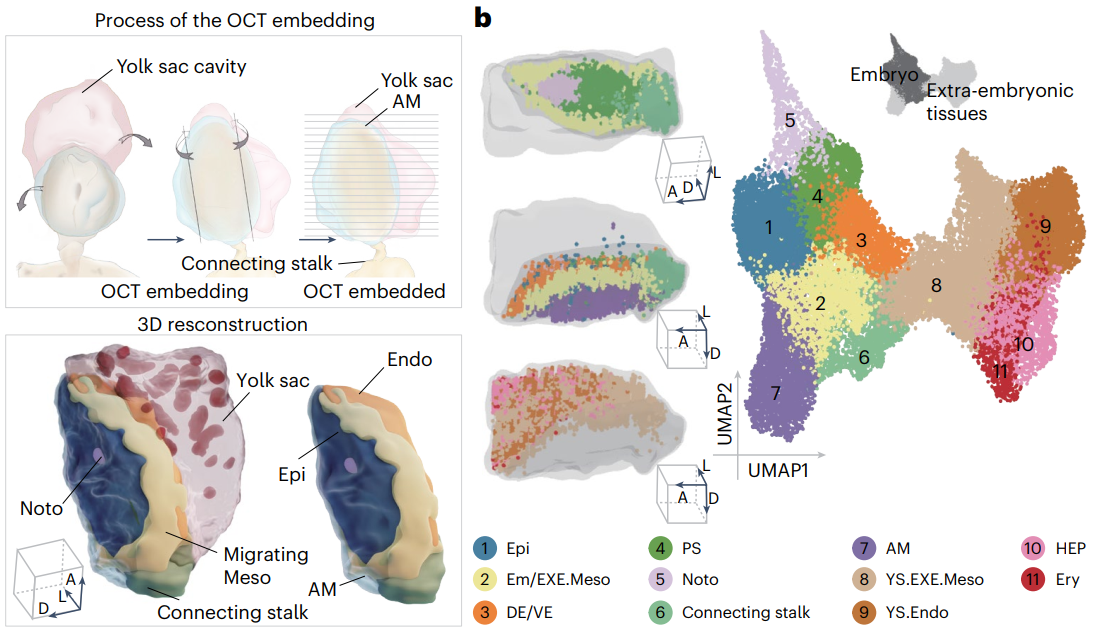
02 原肠胚的空间转录组信息
通过对早期原肠胚的胚胎及胚外细胞(图1b中的cluster 1-6)进行聚类分析,研究人员细分出了11个亚群,并归为以下四个主要组:
原肠胚形成相关细胞:包括位于胚胎盘后区中线附近的原肠运动细胞(Gast)、脊索后端的近轴中胚层(Axial.Meso)、从两侧环绕脊索和轴中胚层的轴旁中胚层(Para.Meso),以及位于原条后端的侧板中胚层(LP.Meso)。
脊索(Noto):位于胚胎盘前中区中线附近。
外胚层相关细胞:包括位于胚盘后部背侧的尾部上胚层(Epi(P))、位于胚盘前部背侧的前部上胚层(Epi(A)),以及位于外胚层盘最外层的羊膜外胚层(AM.Ecto)。
其他组织:包括位于胚胎后端附近的体蒂、位于胚胎盘腹侧的定向内胚层/内脏内胚层(DE/VE),以及位于胚胎最外层的胚外中胚层祖细胞(EXE.Meso.Prog)。
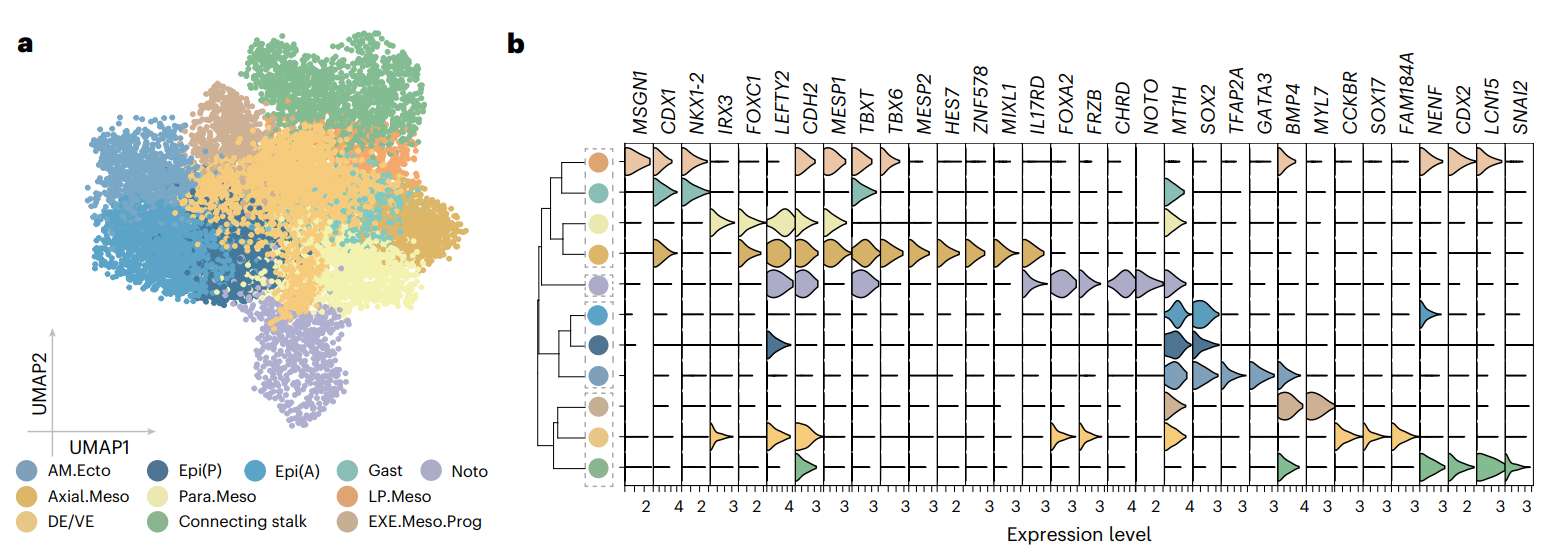
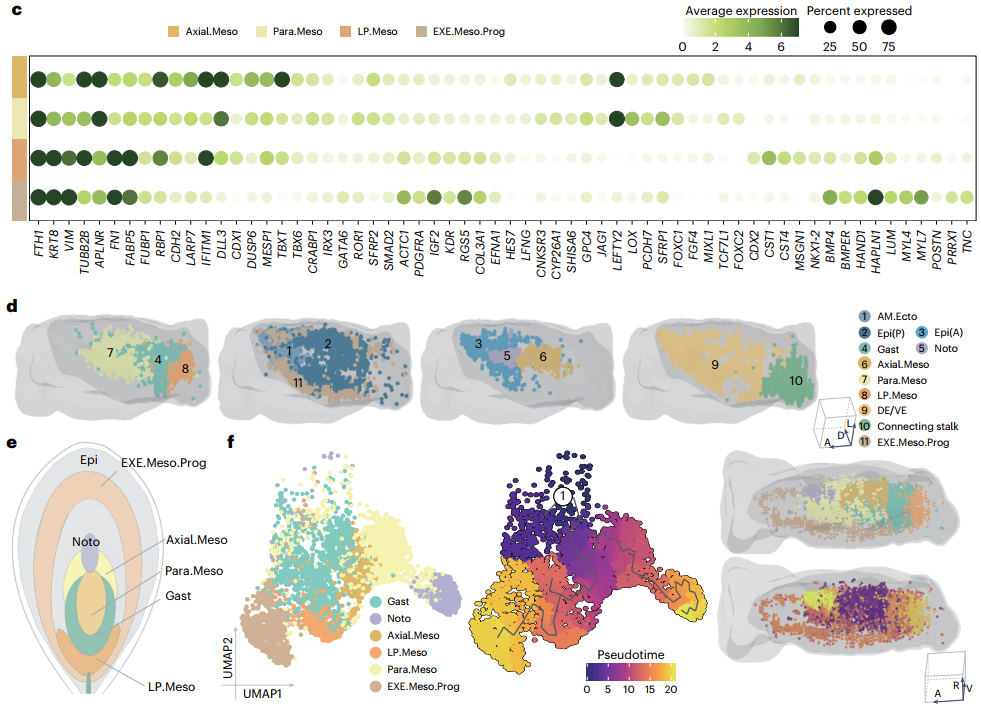
03 早期原肠胚形成过程中的中胚层特化
早期原肠胚形成时,中胚层亚型的marker基因表现出高度相似性,难以精确定义,但研究人员通过基因表达模式和空间定位发现了显著差异。利用monocle3进行拟时序分析并结合3D重建模型,发现各中胚层亚型在原肠胚形成中的发育起始时间不同,路径各异,并显示出不同的基因表达变化模式。研究结果揭示了中胚层特化始于CS7阶段,且分布于不同空间位置。
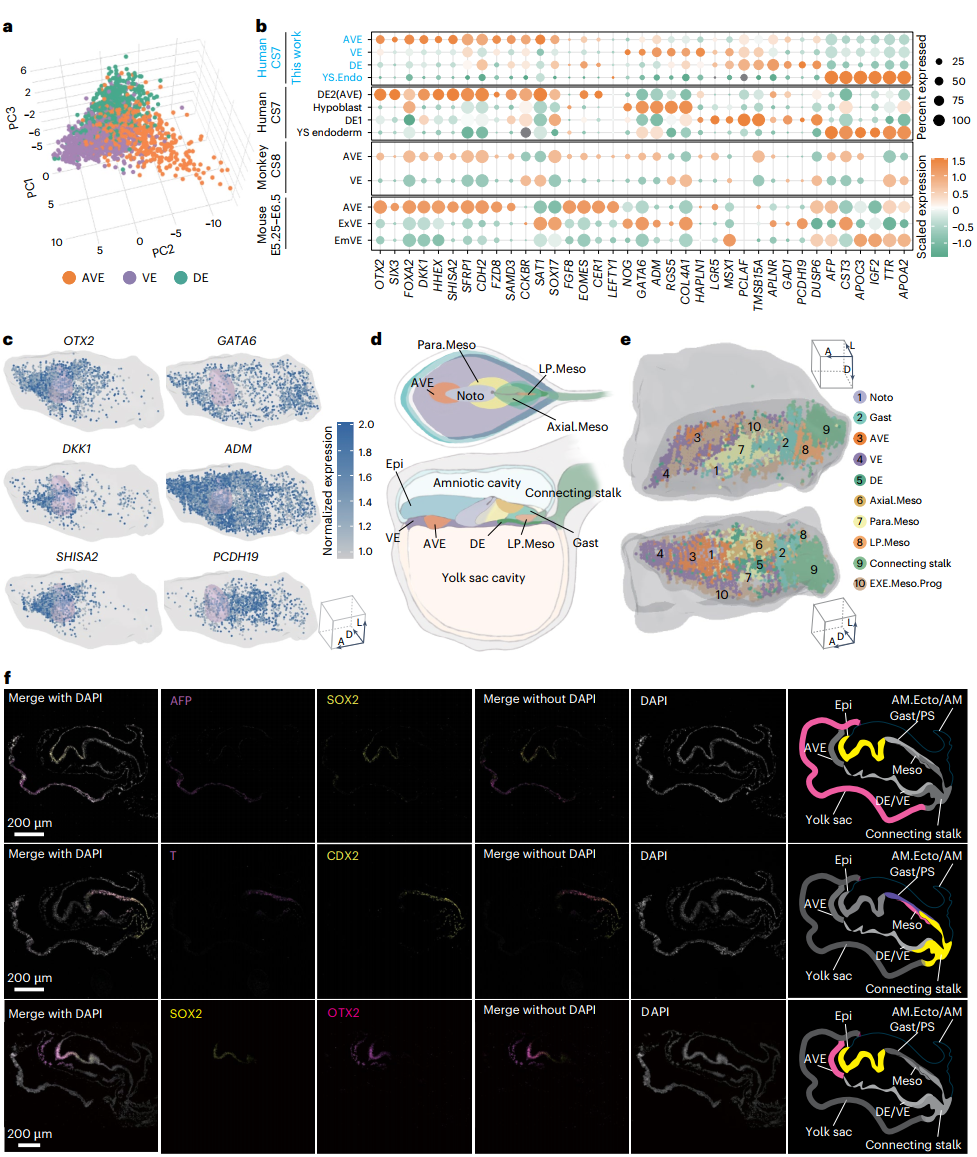
04 前内脏内胚层的鉴定
在胚胎发育的早期阶段,前内脏内胚层(AVE)的迁移行为对于确定胚胎的前后轴至关重要。研究人员发现,位于VE前中央的细胞表现出与小鼠和猴子中类似的表达模式。免疫荧光染色进一步证实了AVE的存在和位置。细胞通讯分析表明,AVE、VE和Noto显示出显著的信号相互作用。AVE分泌BMP,FGF和TGFβ途径的信号因子,与Epi(A)进行通讯,从而调控神经系统发育。此外,AVE还高表达WNT受体和WNT拮抗剂,以协调原条的形成。
05 原始生殖细胞的鉴定和定位
研究人员在体蒂、羊膜、羊膜外胚层、原始外胚层和滋养外胚层的细胞亚群中鉴定出了原始生殖细胞(PGCs),并通过3D重构原肠胚模型探讨了PGCs的分子特性。研究发现PGCs在CS7时期位于胚胎尾端,且可能源自外胚层衍生的细胞。通过与体内PGCs、体外原始生殖细胞样细胞(hPGCLCs)对比,验证了CS7和CS8时期的PGCs在转录组特征上与hPGCLCs高度相似(除DMRT1+ hPGCLCs外),进一步揭示了体内和体外PGCs在发育过程中的分子变化,为理解和优化PGC的培养条件提供了重要的见解。
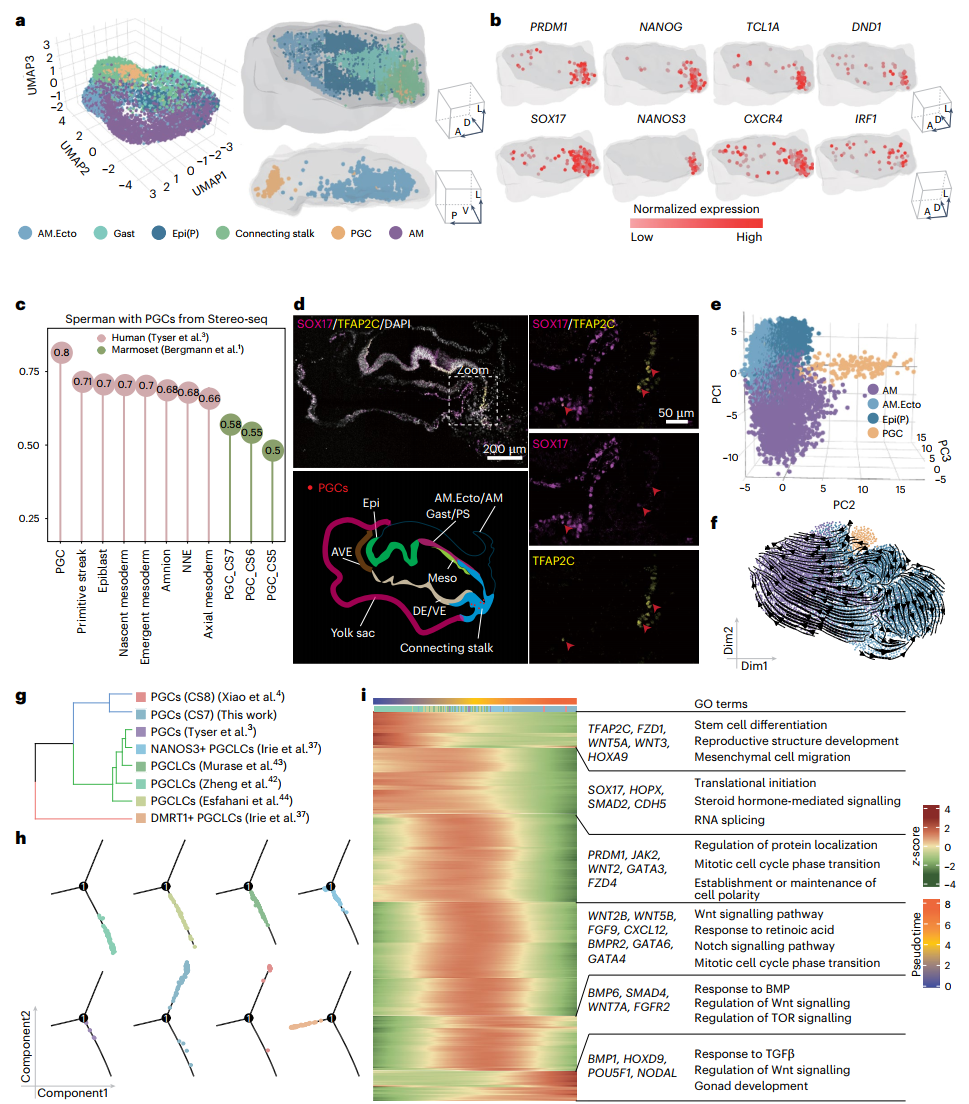
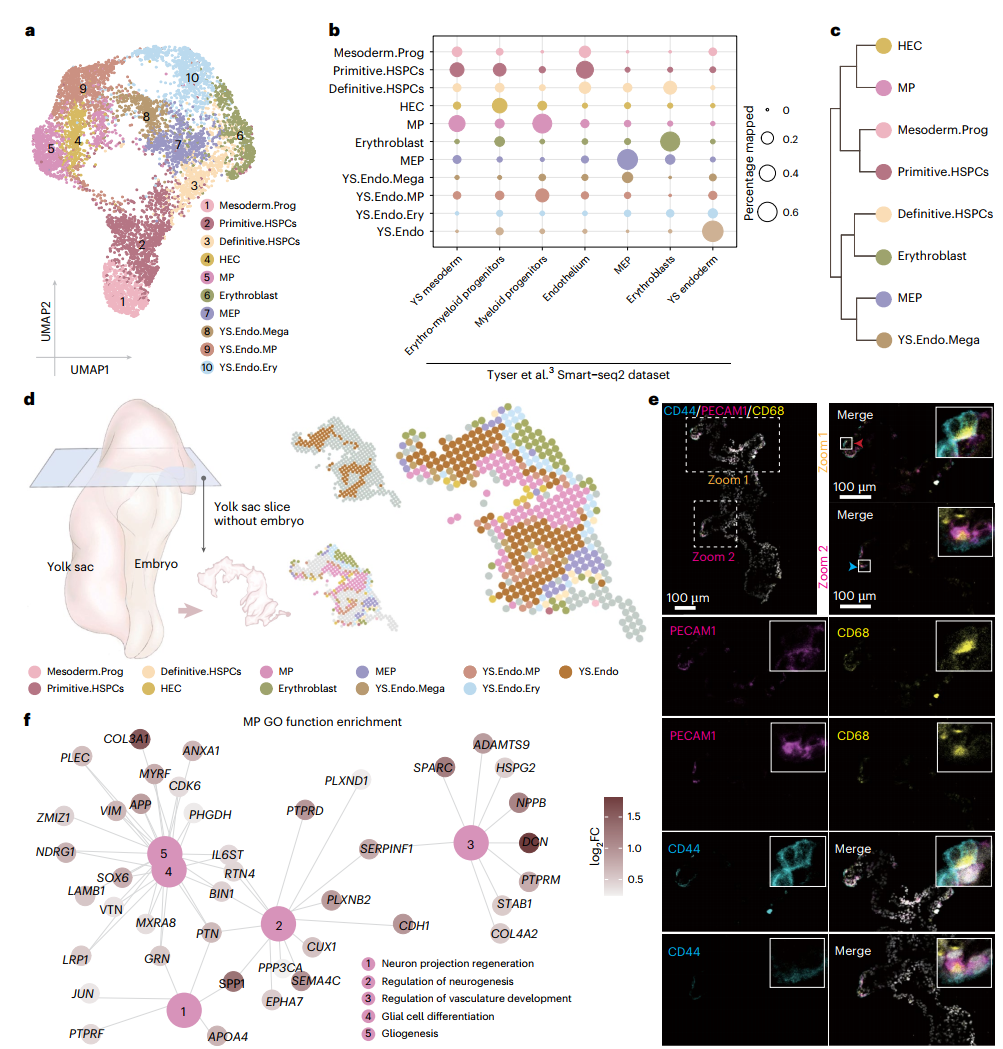
06 造血祖细胞的发育
研究人员识别出10个对于早期血细胞分化和发育至关重要的亚群,其中髓系祖细胞在“神经元投射再生”和“胶质细胞分化”中可能发挥潜在作用,并且与成血内皮细胞之间存在着紧密关联。卵黄囊内胚层巨核细胞则可能参与早期造血过程中的血小板生成和免疫反应。
该研究通过对CS7原肠胚的82个连续冷冻切片进行Stereo-seq实验,重建了CS7胚胎的三维立体模型。在此基础上,研究人员揭示了不同中胚层亚型的早期命运决定机制,并确认了前内脏内胚层的存在。此外,研究还发现原始生殖细胞位于体蒂之中,并且在卵黄囊内观察到了源自造血干细胞的造血现象。这项成果极大地促进了我们对原肠胚发育过程的理解,并为相关领域贡献了珍贵的数据资源。
为了让更多读者能够理解和应用这些研究成果,研究人员还同时建立并发布了可互动共享网站:http://cs7.3dembryo.com。
作为华大时空组学国内首家生态合作伙伴,安诺优达在Stereo-seq定制大芯片方面经验深厚,成功克服大组织切片易皱缩、堆叠等问题。在3D重构项目中,已成功突破连续切片贴片精细化挑战,完成超过400张的高质量3D重构数据。通过完善切片方案、快速准确的切片贴片及个性化实验处理,确保目标结构清晰、分隔明确。并成功助力中国科学家在脑部发育和早期胚胎3D重构领域发表2篇重磅级Cell论文。
截至目前,安诺优达凭借处理各类样本的深厚技术经验,已成功产出1200+张空间芯片数据。同时,安诺优达针对客户的样本特性及研究方向,量身定制个性化分析方案,并推出完整的3D重构生信分析解决方案,旨在为客户的研究结果发表提供有力支持,并推动时空组学和多组学技术在发育生物学、疾病研究等领域的科研发展与应用。







