2025年1月9日,新加坡杜克-国大医学院(Duke-NUS Graduate Medical School)、新加坡国立大学(National University of Singapore)等机构联合发表了一篇题为 “Spatially Resolved Tumor Ecosystems and Cell States in Gastric Adenocarcinoma Progression and Evolution” 的论文。该研究由Patrick Tan教授和Raghav Sundar博士领导,发表于美国癌症研究协会(AACR)出版的《癌症发现》(Cancer Discovery)期刊。
研究团队基于全切片的数字空间转录组技术和配对单细胞RNA测序(scRNA-seq),揭示了胃癌中肿瘤内异质性 (ITH) 的空间分布模式。为了进一步提高空间分辨率并在亚细胞分辨率下验证核心发现,研究团队使用了适用于新鲜冷冻样本的华大时空转录组FF 产品方案进行了验证。新加坡STOmics Demo Lab和MGI对该实验提供了主要支持。

文章页面截图
胃癌在亚洲的发病率较高,是全球癌症死亡的第五大原因。胃癌治疗中的一个关键挑战是肿瘤内异质性(ITH)的存在,这种异质性可能出现在同一肿瘤的不同亚区域、原发性和转移性病变之间,甚至在转移病灶之间。这是因为肿瘤内异质性会导致肿瘤亚克隆的产生,进而促进药物耐药性的产生。尽管DNA层面(DNA-ITH)的肿瘤内异质性已有研究,但转录组层面(RNA-ITH)的研究相对较少。
本研究的开创性在于它进一步将空间信息纳入RNA-ITH的研究,使研究人员能够更深入地理解肿瘤细胞与其局部肿瘤微环境(TME)之间的相互作用。
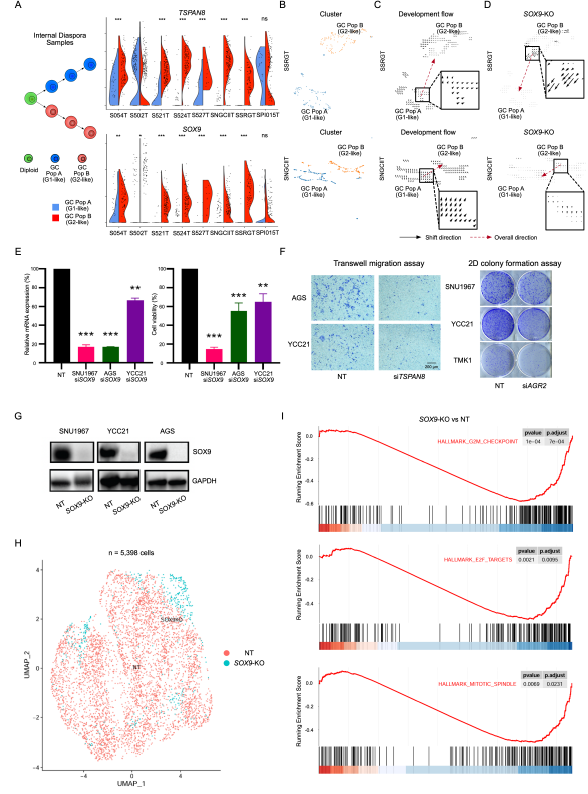
研究人员应用GeoMX DSP和单细胞RNA测序(scRNA-seq)技术,对来自121名胃癌(GC)患者的226个样本进行了深入分析,整合了超过2000个感兴趣区域的数据,并研究了超过150,000个单细胞转录组。配对的GeoMX DSP / scRNA-seq数据集是胃癌领域中包含空间和单细胞级信息的最大数据集之一。这使得研究人员能够识别出2个不同的表达亚群,分别将其命名为“G1”和“G2”。研究发现,G2区域更具侵袭性,并且通常位于肿瘤边缘附近,而G1区域则位于肿瘤核心区域。为了确保结果的可重复性,并进行更高空间分辨率的分析,研究人员将Stereo-seq技术应用于2个胃癌样本中,成功识别了G1和G2 RNA-ITH亚群,这些亚群所富集的通路与通过GeoMX DSP识别的通路具有相似性。

空间分布的胃癌肿瘤内异质性(ITH)
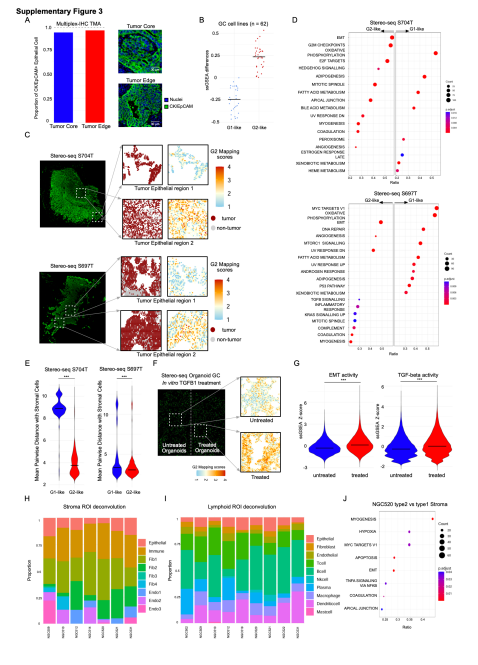
Stereo-seq用于评估GeoMx DSP结果的可重复性
接着,研究人员探究了G1和G2 RNA-ITH亚群在其局部肿瘤微环境(TME)中的差异,发现G2区域显示出免疫耗竭特征,具体为T细胞比例减少,抑制性细胞因子水平升高,这暗示G2 RNA-ITH区域表现出免疫抑制的肿瘤微环境。有趣的是,研究人员还在G1 RNA-ITH亚区域识别出了潜在的治疗靶点,如CAPRIN-1;在G2 RNA-ITH亚区域则识别出了Wnt信号通路关键成分,如DKK1和CTNNB1。这表明空间RNA-ITH可能在胃癌治疗耐药性中发挥潜在作用。

研究人员进一步研究了体细胞拷贝数变异(sCNVs)与局部免疫抑制之间的关系,并发现这种关系是通过激活cGAS-STING通路来介导的。GeoMx DSP数据表明,G2亚区域的sCNVs水平高于G1亚区域。为了进一步增强分析结果的可靠性,研究人员采用了Stereo-seq技术对两个胃癌样本进行了验证,并利用流行的inferCNV工具,证实了这些发现同样在Stereo-seq数据集中得到了重现。此外,研究人员还收集了scRNA-seq数据,进一步分析了肿瘤细胞的进化轨迹,揭示了肿瘤亚群的进化可以划分为两种模型:分支进化模型(sCNVs逐步积累)和内部离散模型(肿瘤进化早期迅速获取sCNVs)。通过与癌症基因组图谱胃癌(TCGA-STAD)数据库和GASCAD队列进行比较,证明了具有内部离散进化的患者样本比分支进化型胃癌患者预后较差。
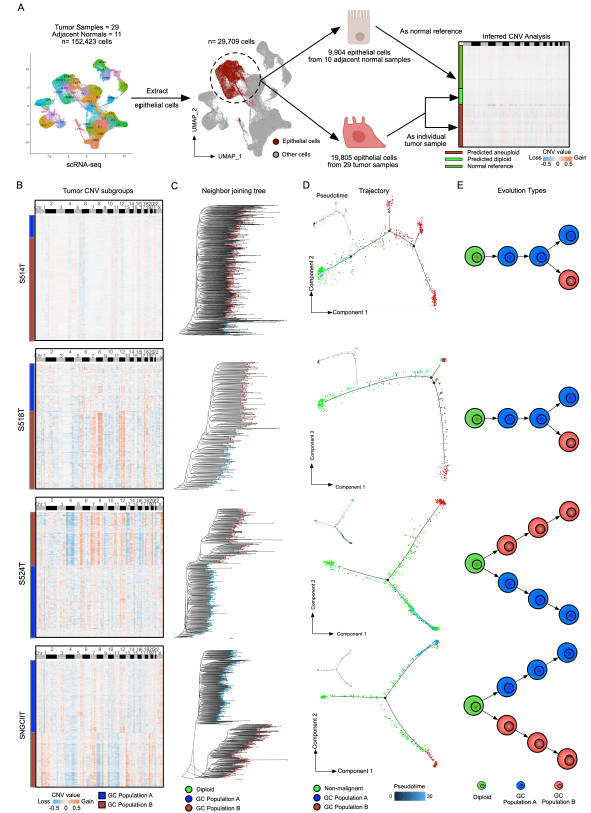
胃癌中的单细胞分辨进化轨迹
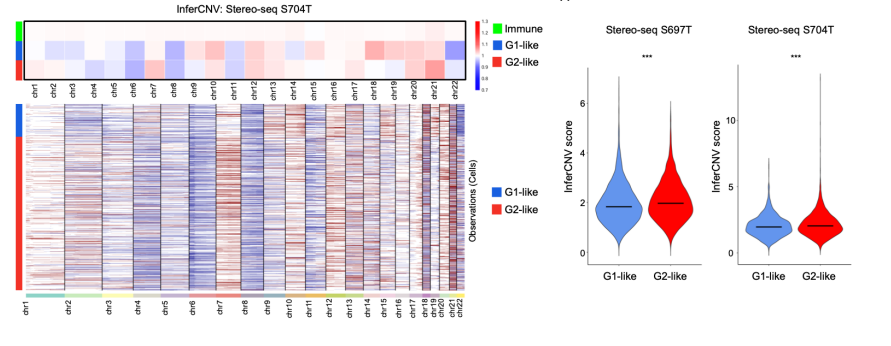
在Stereo-seq数据上运行InferCNV支持G2型细胞中更高的sCNAs
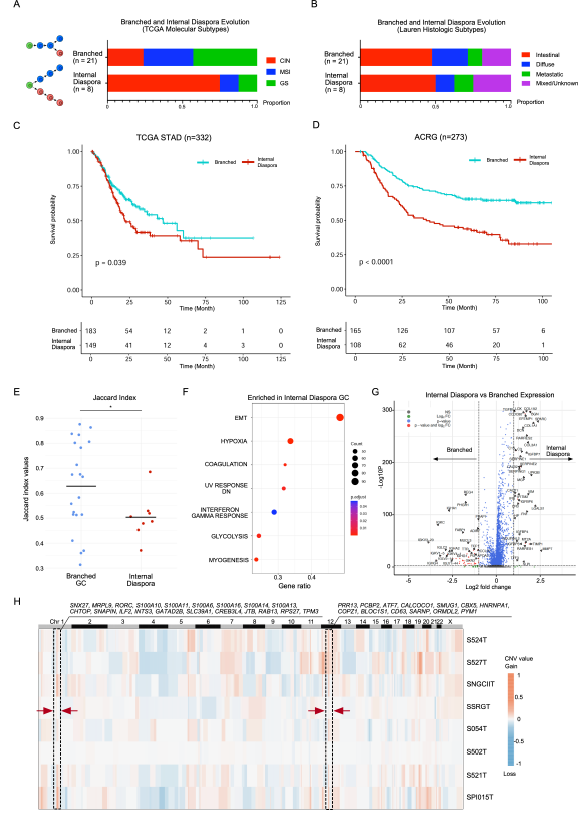
胃癌进展和预后的内部离散型进化
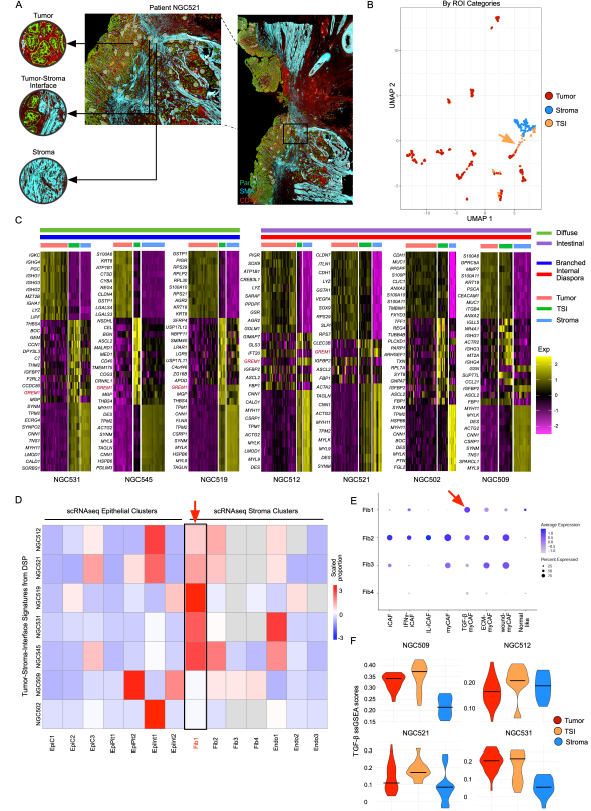
为了研究进化模式(分支进化与内部离散)与肿瘤微环境(TME)之间的关系,研究人员在scRNA-seq数据集中探究了TME的特征,发现内部离散型胃癌(GC)样本中内皮细胞、成纤维细胞和巨噬细胞的比例较高,而分支进化型样本中B细胞的比例较高。他们还对这些细胞类型进行了详细的亚群聚类分析,结果显示,特定的亚群体,如VWF+ ACKR1+ Endo2和SPP1+ FN1+ TAM1(肿瘤相关巨噬细胞)在内部离散型胃癌样本中富集,这些细胞类型已知具有能促进肿瘤生长和转移的能力。他们的scRNA-seq分析结果也得到了GeoMx DSP数据中内部离散型GC的基质区域(Stroma ROIs)数据的支持。
内部离散型胃癌表现出独特的肿瘤微环境
接着,研究人员将对分支进化型和内部离散型胃癌(GC)的分析与G1型和G2型肿瘤群体的特征进行了关联,展示了在内部离散型胃癌中,G2型肿瘤群体中上调的基因,如SOX9、TSPAN8和AGR2,也在这些内部离散型胃癌样本中显著富集。随后,他们通过使用CellOracle工具对公共数据集进行体外敲除,并对多个细胞系进行体外siRNA敲低和CRISPR介导的SOX9敲除,进一步分析了SOX9的作用。这些研究表明,SOX9功能的减少或缺失与野生型细胞相比,会导致细胞活力和细胞迁移能力的下降,表明SOX9可能在推动内部离散型胃癌的肿瘤进展中发挥关键作用。

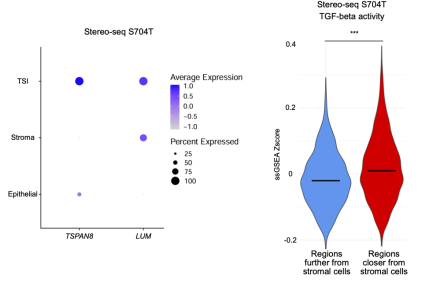
最后,研究人员深入分析了肿瘤-基质界面(TSI)这一特定癌症标志物,发现TSI中正常细胞与肿瘤细胞相互混杂并广泛作用。在TSI的GeoMx数字空间分析感兴趣区域(ROIs)中,他们观察到与转化生长因子-β(TGF-β)通路相关的GREM1基因显著富集,暗示肌成纤维细胞样肿瘤相关成纤维细胞(myCAFs)在TSI中富集。为验证此发现,研究人员将两种GREM1表达的CAF细胞系(PT13CAF和PT54CAF)与胃癌类器官细胞(PT25GC)进行共培养,并通过RT-PCR技术检测到这两种CAF细胞系中GREM1表达均显著上调。进一步分析两个Stereo-seq胃癌样本后,研究人员成功区分了TSI、基质区域和肿瘤区域,并发现靠近基质细胞的肿瘤区域TGF-β水平明显升高。基于此,他们推测GREM1表达增强及TGF-β信号增强可能是胃癌TSI的潜在生物标志物。
肿瘤-基质界面代表独特的TGF-β介导的细胞状态
Stereo-seq数据集突出显示,靠近基质细胞的区域具有更高的TGF-β活性
该研究创建了迄今为止胃癌(GC)领域最大的GeoMx DSP数据集之一,并通过使用Stereo-seq胃癌数据进行了正交分析来支持该研究。通过将空间转录组学分析与单细胞测序相结合,研究揭示了具有独特分子特征、进化轨迹和肿瘤微环境特征的不同空间肿瘤亚群,为胃癌精准医学治疗的潜在靶点发现提供了重要依据。
生命科学的进步有赖于技术工具的进步,时空团队也持续聚焦应用场景和用户需求,对技术和产品进行优化升级,帮助广大科研人员进行更广、更深层次的组学探索。目前,依托Stereo-seq技术,华大时空已推出了时空蛋白转录组Stereo-CITE、时空转录组FFPE、时空转录组FF V1.3、时空转录组大尺寸芯片等多组学产品方案。点击查看详细产品方案>>>定制你的科研利器,总有一款适合你
为了进一步推动时空组学技术在更多领域的广泛应用,华大时空组学也致力于推进全球科研合作和生态合作伙伴建设,打造时空生态圈。目前,华大时空组学已与安诺优达、诺禾致源、欧易生物、联川生物、基迪奥生物、百奥智汇、新加坡觅瑞(Mirxes)等国内外多家头部生物科技公司达成合作,同时,新加坡、日本东京、澳大利亚布里斯班均有DCS demo lab落地,全面助力研究人员在生命发育和疾病病理方面取得关键进展。










