南方科技大学翟继先课题组与中国农业科学院作物科学研究所大豆优异基因资源发掘与创新利用创新团队阎哲研究员合作,应用snRNA-seq,以及包括华大自主研发的Stereo-seq在内的空间转录组学技术,构建了大豆根瘤和根的空间分辨单细胞核转录组图谱,揭示了大豆根瘤成熟过程中基因表达的动态变化,并在未成熟的根瘤侵染细胞中鉴定出一组参与根瘤成熟和根瘤固氮的过渡性细胞亚型,这为理解根瘤菌-豆科植物共生提供了新视角。该文章在2023年4月13日发表于Nature Plants,以下是文章的详细解读。

文章题目:Integrated Single-Nucleus and Spatial Transcriptomics Captures Transitional States in Soybean Nodule Maturation
发表时间:2023-04-13
发表期刊:Nature Plants
主要研究团队:南方科技大学、中国农业科学院作物科学研究所等
影响因子:17.352
DOI:10.1038/s41477-023-01387-z
研究背景
在亲和互作的寄主植物中,根瘤菌感染并在根部形成共生器官根瘤,建立固氮根瘤,将大气中的氮转化为有机氨供寄主植物利用。在这种高度异质性的根瘤组织中,各种类型的细胞具有不同的功能,一些重要的生理和转录组学程序仅在某些特异性细胞类型中活跃。
目前,有关根瘤中不同类型细胞的具体贡献以及它们在根瘤成熟过程中的动态特征仍不明确。为此,来自南方科技大学和中国农业科学院作物科学研究所的研究团队,联合scRNA-seq、Stereo-seq、RNA原位杂交等技术对大豆根瘤成熟过程中细胞类型特异性的动态基因表达进行全面研究,构建了大豆根瘤的细胞图谱,并确定了稀有细胞亚型及其对根瘤成熟和功能的重要作用。
研究样本
snRNA-seq和Stereo-seq:大豆(Glycine max L. cv Williams 82)被根瘤菌浸染后第12天(12 dpi)和21 dpi时的根瘤组织,以及21 dpi根瘤形成时的根相应区域样本。
研究成果
1. 大豆根瘤和根的单细胞核转录组图谱
应用snRNA-seq技术,研究人员分析了来自两个不同发育阶段(根瘤菌感染第12天和第21天)的根瘤,以及21 dpi根瘤形成时的根相应区域(对照),共获得26,712个高质量的单核转录组,包括39,337个基因,每个核的中位数基因数为1,342,每个核的中位数唯一分子标识符(UMIs)为1,636(图1a)。研究人员使用scVI对3个数据集进行整合后,识别出15种不同细胞簇和每个簇的一系列上调基因,同时鉴定了各样本之间每个簇的差异表达基因(图1b、1c)。
进一步应用高分辨率、高灵敏度的时空组学技术Stereo-seq研究相同发育阶段大豆根瘤基因的空间表达,研究人员验证了snRNA-seq检测到的细胞簇身份,并根据它们在空间上的分布进一步分配:cluster 0[中央浸染区(central infected zones,CIZ)]、cluster 2(外皮层)、cluster 4(外皮层)、cluster 7(CIZ)和cluster 11(CIZ)(图1c、1d)。同时,研究人员通过β-葡萄糖醛酸酶染色和细胞类型特异性基因的RNA原位杂交验证了细胞注释结果(图1e)。
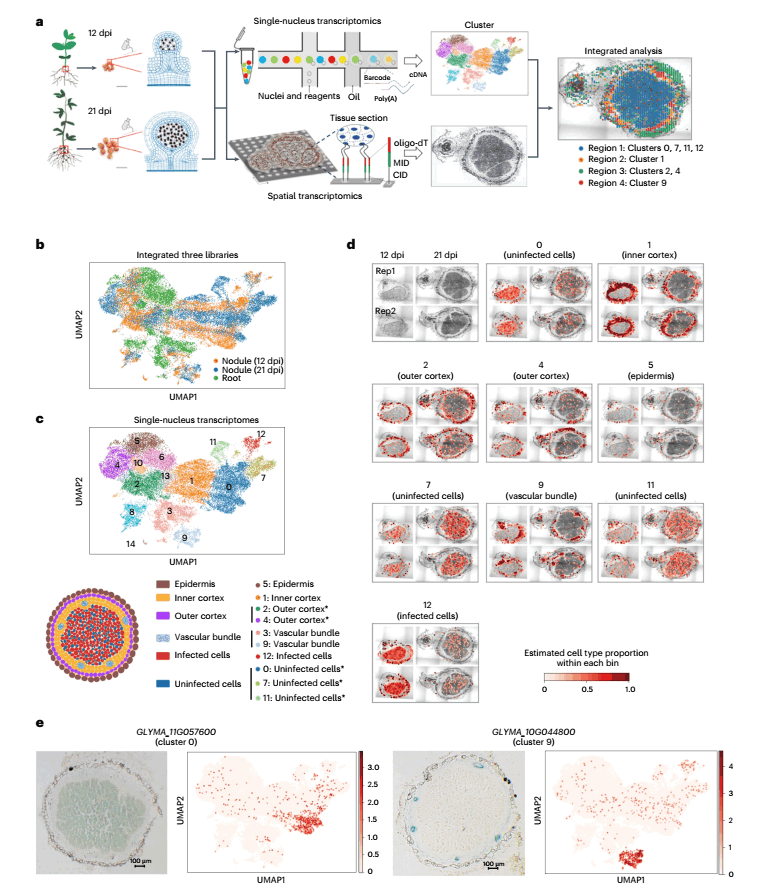
图1 单核和空间转录组联合揭示不同发育阶段的根瘤细胞异质性
2. 根瘤中央浸染区的不同细胞亚型
大豆根瘤CIZ共分布有4种细胞簇:cluster 0、cluster 7、cluster 11和cluster 12(图1d)。研究人员基于大豆根瘤的单核数据集,研究了日本百脉根根瘤中根瘤菌未浸染细胞(uninfected cells,UCs)和浸染细胞(infected cells,ICs)基因的大豆同源物的表达模式,确定了cluster 0、cluster 7、cluster 11为UCs,cluster 12为ICs(图2a)。在UCs中,cluster 0存在于两个不同发育阶段的根瘤中,而cluster 7和cluster 11几乎只在21 dpi根瘤细胞中被发现(图2b),表明cluster 7和cluster 11出现在根瘤成熟的后期。
为揭示这两个UC clusters的分化轨迹,研究人员使用三种主流的轨迹推断算法对所有UC clusters(cluster 0、cluster 7、cluster 11)进行拟时序分析,发现分化方向是从cluster 0到luster 7和cluster 11(图2c),表明luster 7和cluster 11在根瘤成熟过程中是由cluster 0分化来的。
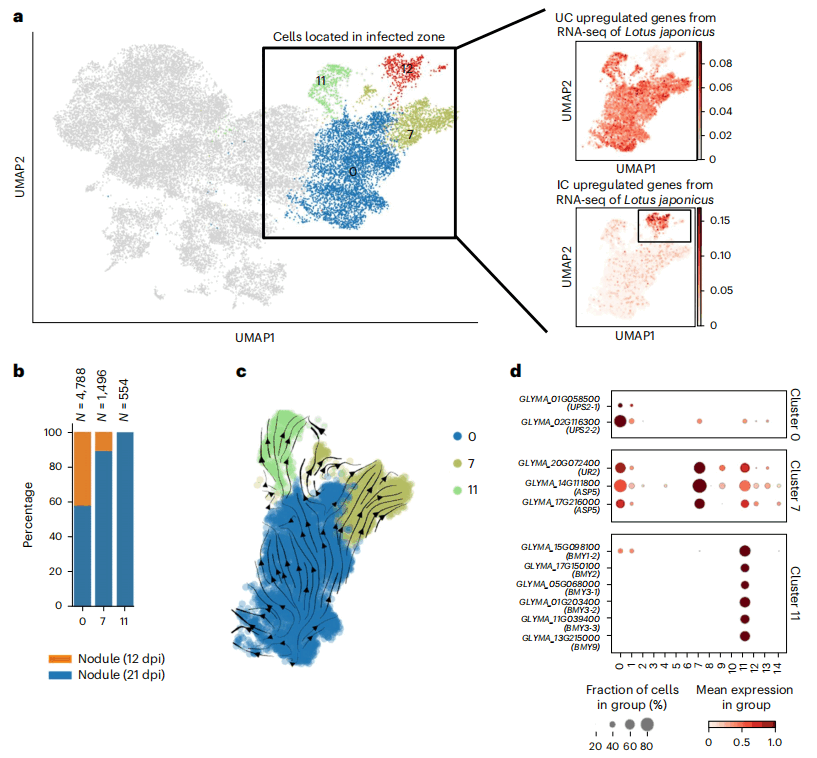
图2 大豆根瘤中央浸染区中的不同细胞亚型
在大豆等热带豆科植物中,根瘤中固定氮的主要输出形式是酰脲。酰脲主要在 UCs中合成,负责酰脲生物合成的酶在UCs中具有更高的比活性。研究人员发现,在酰脲生物合成中,根瘤中表达的尿酸酶和天冬氨酸氨基转移酶基因在所有3个UC clusters中均有表达,特别是在cluster 7中表达上调;而在酰脲运输中,3个酰脲渗透酶基因中的2个主要在cluster 0中表达(图2d)。此外,研究人员发现8个β淀粉酶基因中有6个在cluster 11中表达显著上调(图 2d),并且与多糖分解代谢过程、淀粉分解代谢相关的通路也被激活,表明cluster 11参与了共生固氮的能量供应。
3. 根瘤浸染细胞的不同亚型及其作用
接下来,研究人员重点关注了根瘤ICs,即共生固氮的核心位点(core sites)。研究人员发现,所有豆血红蛋白基因和一些结瘤素蛋白基因在cluster 12中高度表达。同时,还发现编码糖转运蛋白的8个基因和属于异丙基苹果酸合酶家族的5个基因出现在cluster 12的上调基因中,表明ICs中大豆和根瘤菌之间存在活性碳和氮交换。通过重新聚类ICs,研究人员发现它们可以进一步分为两种亚细胞类型:包含492个细胞核的12-0和包含38个细胞核的12-1(图3a)。其中12-0亚群存在于两个不同发育阶段的根瘤中,而12-1小亚群几乎完全只出现在12-dpi未成熟根瘤中(图3b)。研究人员进一步使用RNA原位杂交验证了这两种细胞亚型的特异性基因的表达模式,证实12-0和12-1亚群是两种不同的细胞类型(图3c)。在UCs中,编码共生体膜蛋白13的基因在12-0亚群的表达水平中远高于12-1和其他亚群(图3d),表明在根瘤感染区12-0亚群的共生体之间溶质的运动更活跃。
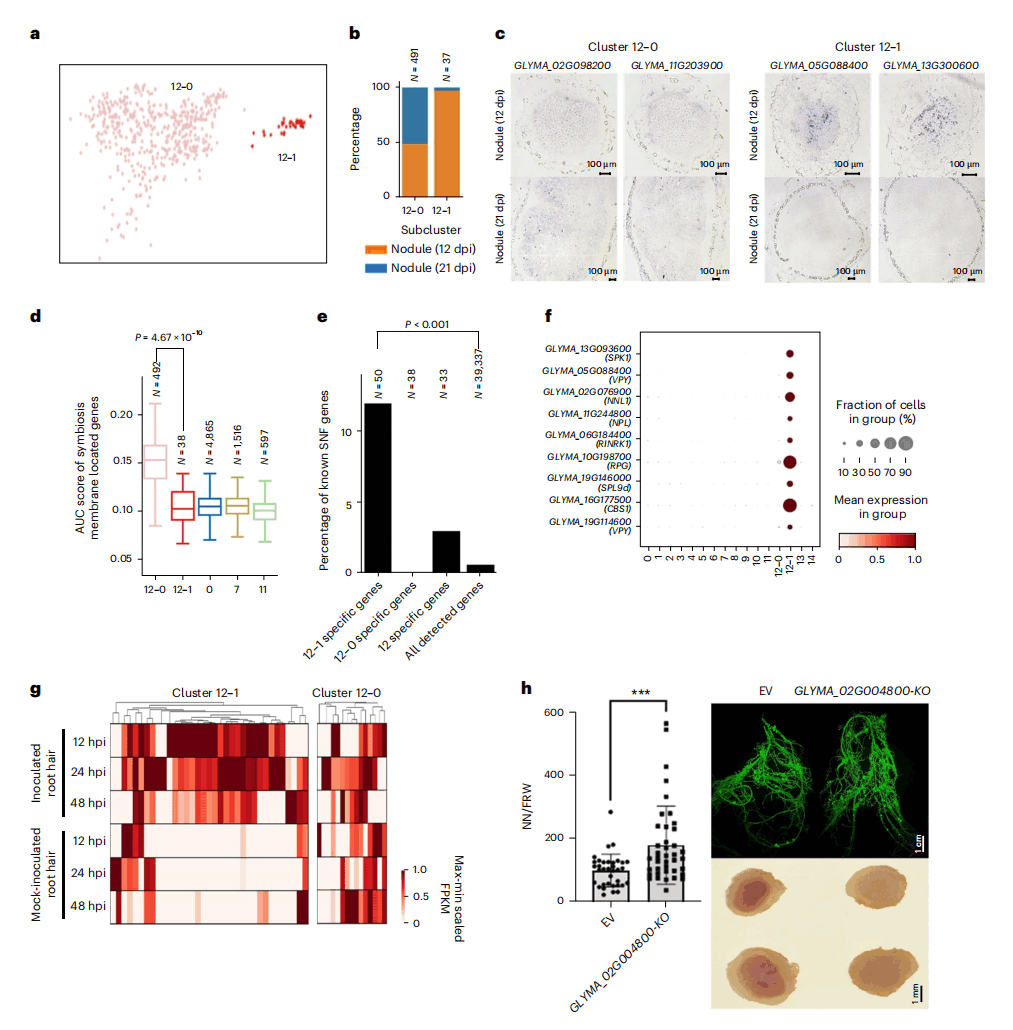
图3 ICs中12-1亚群对根瘤的成熟和功能至关重要
接着,研究人员分析了12-1亚群的特异性表达基因(图3e~3g),结果显示,12-1亚群可能参与了大豆根瘤成熟过程中ICs的转录因子扩增和根瘤菌释放,而在这些细胞中特异性表达的基因(SPK1、NNL1、NPL等)可能在大豆与根瘤菌的相互作用,以及共生建立的最后阶段发挥了关键作用。然后,研究人员利用毛状根转化CRISPR-Cas9敲除12-1亚群的特异性表达基因GLYMA_02G004800后,发现近50%(14/30)转基因根瘤的数量增加,感染区呈白色,这为揭示12-1亚群在根瘤成熟过程中的重要性提供了线索(图3h)。
总 结
本研究通过结合不同发育阶段大豆根瘤的单细胞与空间转录组数据,构建了根瘤的单细胞核转录组图谱(https://zhailab.bio.sustech.edu.cn/single_cell_soybean),并确定了ICs中12-1亚群及其在根瘤成熟和功能中的重要作用。总之,本研究获取的实验数据为在单细胞分辨率下进一步研究根瘤成熟的调控网络提供了新见解。
文献引用格式:
Liu Z J, Kong X Y, Long Y P, et al. Integrated single-nucleus and spatial transcriptomics captures transitional states in soybean nodule maturation[J]. Nature Plants, 2023, 9(4):515-524. doi: 10.1038/s41477-023-01387-z.
作者/审校:Lina




