2023年9月11日,北京大学生命科学学院和北京大学-清华大学生命科学联合中心研究员杜鹏课题组在Cell Press细胞出版社旗下期刊Cell上在线发表了题为“Spatiotemporal insight into early pregnancy governed by immune-featured stromal cells”的研究论文。

课题组结合使用单细胞转录组和华大自主研发的时空组学技术Stereo-seq首次对小鼠妊娠早期(E5.5-E10.5)着床位点的细胞组成进行了详细定义,并根据不同细胞的空间动态分布,鉴定出妊娠早期着床位点的8个不同功能中心,最终通过比较健康小鼠和复发性流产模型小鼠着床位点功能中心的差异,进而揭示了胚胎着床初期蜕膜微环境建立及稳态维持是成功妊娠至关重要的条件。
- 研究背景 -
妊娠过程包括各种细胞之间相互作用的复杂生命学活动。子宫内膜蜕膜化过程连接了胚胎着床和胎盘发育,对成功妊娠至关重要。蜕膜化过程是子宫内膜基质细胞发生形态和功能上的变化,形成蜕膜基质细胞,同时也是一个典型的MET(mesenchymal-epithelial transition)过程。蜕膜基质细胞、免疫细胞和血管内皮细胞等共同形成子宫内膜组织,该组织为胚胎早期发育提供营养,能量传递以及帮助建立母胎交流界面。
目前有多篇研究利用单细胞及空间多组学聚焦于人体母胎界面的深入探究,包括蜕膜组织和胎盘组织的研究,详细刻画了人类妊娠6-20周龄母胎界面的细胞组成,细胞间相互作用和各种生物学过程。但是该时期为胎盘开始发育并逐渐产生功能,并非是母体和胎儿的真正意义上的第一次接触。由于伦理和技术难题,我们无法获得人围着床时期的子宫内膜样本,因此小鼠可以作为研究胚胎着床初期子宫微环境建立的最佳选择。然而,迄今为止,小鼠着床位点的子宫内膜组织还未进行全面解析。
- 研究策略 -
研究人员使用带有tdTomato荧光的雄性小鼠与野生型雌性小鼠进行杂交,对妊娠E5.5-E10.5期间的母体来源的子宫组织内的细胞和红色荧光的胎儿来源细胞进行富集和单细胞转录组测序。最终研究人员得到8个母体来源和5个胚胎来源的主要细胞类型,随后,对母体来源的子宫内膜蜕膜细胞(DSC)、免疫细胞和血管内皮细胞进行亚型分析。
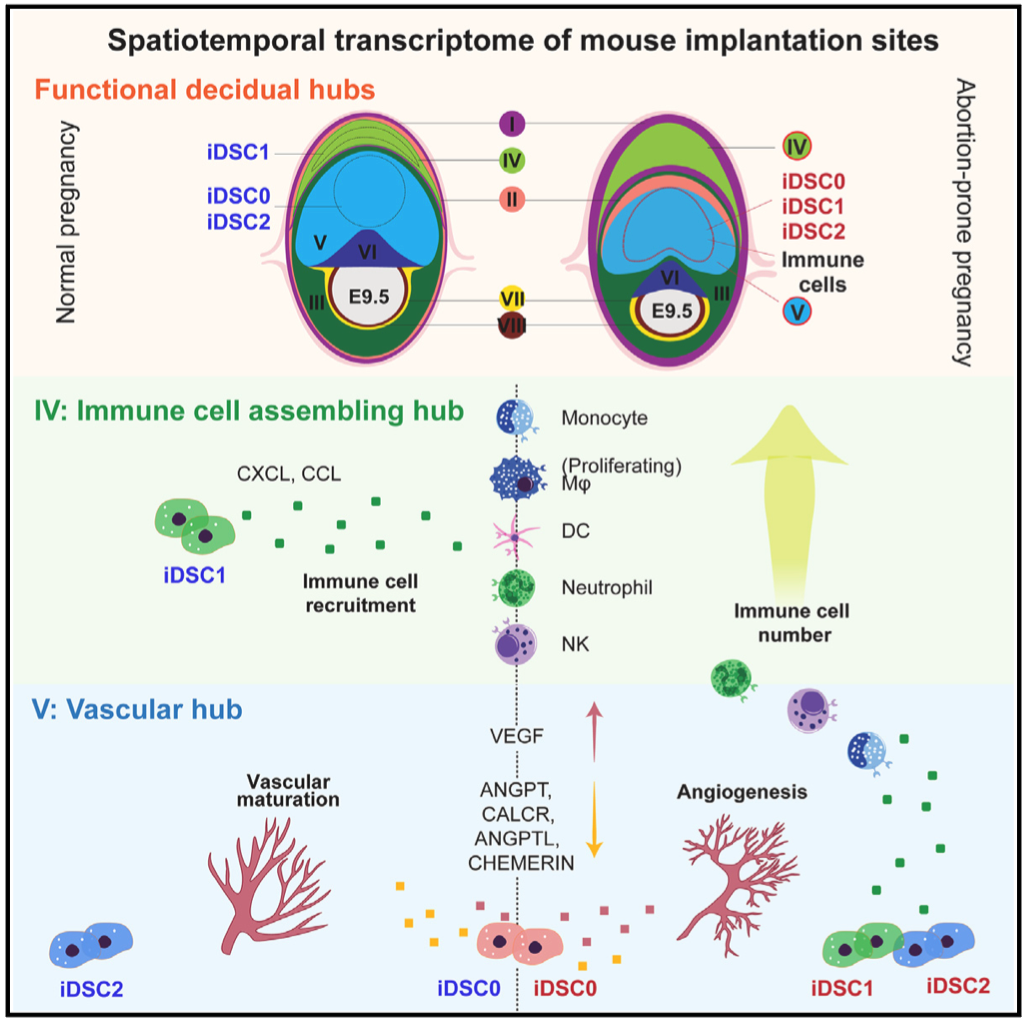
同时,作者利用华大自主研发的时空组学技术Stereo-seq,对小鼠妊娠早期E6.5-E9.5的着床位点进行亚细胞分辨率的空间转录组测序,将单细胞转录组细胞类型映射至空间转录组上,由此鉴定出着床位点以蜕膜组织、免疫细胞、血管内皮细胞和滋养层细胞亚型等组成的8个功能中心(functional hub, hub I-VIII)。其中,功能中心I至III主要由蜕膜基质细胞构成,是蜕膜化过程的主要发生区域;功能中心IV(免疫招募中心)富含免疫细胞;而功能中心V(血管生成中心)则富集血管内皮细胞和血管生成相关的蜕膜细胞亚群。功能中心的细胞比例和空间位置分布随时间的动态变化代表妊娠过程中关键生物学事件的发生。
模式图表示iDSC蜕膜基质细胞亚群异常导致妊娠早期子宫微环境稳态失调
- 研究发现 -
首先,研究人员聚焦于主要由蜕膜基质细胞组成的功能中心I-III。蜕膜基质细胞在单细胞样本中细胞比例最高,也是蜕膜组织中最为主要的细胞类型。作者通过差异基因分析和细胞通路富集分析,共定义出7个主要的功能性蜕膜基质细胞亚群,结合拟时间分析、转录因子富集分析和体外诱导基质细胞蜕膜化实验。对蜕膜化过程的状态转变和转录因子调控网络做出了详细描述,主要为未分化的基质细胞亚群D1首先发生MET变换为中间态细胞D2,随后进入增殖状态(D3),再分化产生两个功能性分支:位于系膜侧(M)的血管形成相关蜕膜基质细胞(D6)和系膜对侧(AM)的营养供给相关的蜕膜基质细胞亚群(D5),最终走向凋亡(D7)。
随后,研究者发现一群特殊的蜕膜基质细胞亚群,同时表达蜕膜基质细胞的特征基因和免疫活动相关的特征基因,将其命名为免疫特征的蜕膜基质细胞亚群(iDSC)。该群细胞整体转录组与血管生成的蜕膜基质细胞亚群相似,E8.5之后空间定位于免疫招募中心和血管生成中心。接着,进一步将其分为三个亚群,iDSC0/1/2,结合空间转录组数据Stereo-seq,免疫荧光染色和ISS(in situ sequence)结果显示该三个亚群随着妊娠过程呈现不同的空间定位。
其中iDSC0高表达与血管发育相关的基因(如: Angpt2, Runx1, Jcad 和 Adam12);iDSC1亚群高表达炎症反应相关基因(如: Clec4a2, Cxcl2, Ccl6 和Aif1);iDSC2高表达细胞溶解和凋亡相关的基因(如: Prf1, Gzma/e, Tnfrsf9 和Spp1)。空间定位上,iDSC0和iDSC2主要位于血管生成中心,iDSC1位于免疫招募中心。综合iDSC亚群分子特征和空间定位,由此推测,iDSC三个亚群分别在免疫反应和血管生成等生物学活动中扮演重要角色。
研究人员进一步结合细胞类群的定位以及着床位点细胞亚群间信号通路分析发现:iDSC0亚群空间上与D6血管形成相关的蜕膜基质细胞亚群定位高度一致,并且高表达血管生成信号如:VEGF、ANGPT(L)、CALCR和CHEMERIN等的配体基因,使得静脉/动脉血管内皮细胞在系膜侧区域(mesometrial region)富集,并最终形成血管生成中心。
iDSC1定位于免疫招募中心,高表达CXCL和CCL趋化因子,招募免疫细胞在E9.5时聚集形成一个位于两层未分化的基质细胞(D1_eSFs, endometrial stromal fibroblasts)的环状结构,即免疫招募中心。iDSC2亚群高表达Tnfrsf9基因,从而增强颗粒酶和穿孔素等基因的表达,诱导蜕膜基质细胞的凋亡。体外细胞毒性实验室和细胞迁移实验也均证明了iDSCs的不同功能。最终,iDSCs和其他蜕膜基质细胞亚群共同作用完成了着床位点各功能中心的特化和物理分隔,减少生物学活动潜在的相互干扰,从而帮助建立子宫微环境并维持其动态平衡。
最后,作者通过比较健康小鼠和复发性流产小鼠模型的着床位点细胞转录组和空间位置分布差异发现,iDSC三个亚群相较于其他蜕膜基质细胞亚群具有更强的功能失调表型,包括免疫招募通路的趋化因子表达上调,以及血管成熟信号下调。同时iDSC1亚群异常定位于血管生成中心,导致免疫细胞异常富集在血管生成中心,致使血管生成过程异常。由此推测,空间定位和分子异常的iDSC致使着床位点的功能中心特化失败,并最终导致妊娠失败。
杜鹏研究员表示该项研究首次建立了胚胎着床后的子宫微环境图谱,包括各功能中心特化过程、微环境建立和稳态维持过程,也是首次使用空间转录组技术发现细胞异常的空间定位与疾病发生发展之间的关系。同时也相信,随着新技术的不断涌现,我们在疾病和肿瘤等领域的研究也会迎来更多新的思路和观点。
- 作者采访 | 杜鹏研究员 -
杜鹏博士,北京大学生命科学学院/生命联合中心研究员,长聘副教授。2012年于北京大学获得博士学位,后进入哈佛大学医学院/波士顿儿童医院从事博士后研究。2018年起任北京大学生命科学学院/生命科学联合中心研究员,助理教授/长聘副教授。主要从事干细胞和转化医学中RNA生物学相关研究。其研究团队首次通过剪接体抑制,实现了一种新型全能性胚胎干细胞(TBLCs)的稳定体外培养,这些细胞在分子和功能上与体内的2-和4-细胞胚胎相当,并具有最高的发育潜力,为转化医学提供了高质量的“种子细胞”,具有广阔的临床应用前景(Cell, 2021)。
同时在哺乳动物中进行基于RNA的跨物种基因工程改造,并进一步探索相关的生物医学应用。利用植物源免疫蛋白RDR1,通过修复有缺陷的miRNA通路来实现广谱的抗肿瘤反应,首次提出了跨物种基因治疗肿瘤的新思路和新策略(Cell, 2022)。揭示了一种新颖的全局miRNA剂量调控机制,该机制由可选择性转录激活控制,通过相分离聚集Microprocessor复合物来决定胚胎胚层的特化(Nature, 2021)。以独立及共同通讯作者,分别在Cell, Nature和Cell Stem Cell 等期刊上发表论文。并获得国家杰出青年科学基金,基金委原创探索计划项目,科技部国家重点研发计划及颠覆性技术创新项目的支持和资助;入选首届“亚洲青年科学家基金项目”;曾获顾孝诚讲座奖,中国干细胞协会卓越青年研究员奖,中源协和突破创新奖,勃林格殷格翰青年研究员奖等荣誉。
- Cell Press作者专访 -
Cell Press细胞出版社特别邀请杜鹏研究员进行了专访,请他为大家进一步详细解读。
Cell Press:子宫内膜蜕膜化过程是如何影响胚胎发育的,异常的子宫内膜蜕膜化可能导致出现哪些问题?
杜鹏研究员:子宫内膜组织可以为早期胎儿发育提供营养,同时也是气体交换中心。目前的研究表明,异常的子宫内膜蜕膜化可能导致的疾病包括子宫内膜异位症、子痫和胎儿早产或者流产等,但是对于这些疾病中具体的发病机制却知之甚少。
从小鼠正常和疾病模型数据比较可以看出,子宫内膜蜕膜组织细胞的转录组异常,例如炎症因子表达的异常积累,以及蜕膜组织细胞亚型错误的空间定位均有可能导致免疫细胞活动和血管生成过程的失调。然而免疫招募和血管生成与胎盘的母胎界面耐受平衡和螺旋动脉血管产生等又息息相关。因此,子宫内膜蜕膜化过程的稳态建立对胚胎的发育至关重要。
Cell Press:小鼠中,iDSC蜕膜基质细胞亚群对早期妊娠微环境的建立和稳态条件至关重要,那么您认为iDSC细胞类型在人中是否保守,或者又有何不同呢?
杜鹏研究员:首先小鼠和人在发育过程中既有相似性,同时也具有很大差异。妊娠过程中,小鼠的蜕膜化过程开始于着床后的一瞬间,而人的子宫内膜蜕膜化过程是随每个月周期产生,但是他们都同时受到相同的激素和各种细胞因子的调节。
人的围着床时期的样本无法取得,因此目前的研究主要是围绕6-20周龄时间段展开。在这项研究最后,我们也下载了已发表的两个人母胎界面的单细胞转录组数据集与小鼠的数据集进行比较。首先该两个关于人的数据主要取自于6-14周龄的母胎界面,该时期相当于小鼠E13.5阶段。比较结果我们发现,人和小鼠的蜕膜基质细胞亚型差异是非常大的,但是我们同样也在人数据样本中发现了一群细胞,同时表达人蜕膜基质细胞的特征基因和免疫活动相关的基因,也就暗示人妊娠界面中同样存在与小鼠相类似的iDSC蜕膜细胞亚群。
并且比较人复发性流产妊娠样本和正常妊娠样本,我们也发现在疾病中iDSC同样也表现出更强的炎症反应,该现象也与小鼠疾病模型结论相似,但该结论还需要进一步的实验验证。如果这种细胞类型与复发性流产等疾病相关,那么未来或许可以通过调整或修正该细胞类型来解决相关的临床问题。
Cell Press:您认为早期胚胎发育最关键的影响因素有哪些?
杜鹏研究员:任何事物的本质都离不开外在因素和内在条件,胚胎发育也不例外。我们既应该关注胚胎细胞本身的增殖分化的内在影响,例如胚胎发育的转录因子、表观变化等。同时胚胎发育过程的环境变化同样影响着胚胎发育的过程。
胚胎发育过程中,环境变化又可以分为两部分,首先是刚着床时期,胚胎着床于子宫内膜,这是母体和胎儿建立的第一次联系。随后,子宫内膜蜕膜化产生蜕膜组织,该组织是母体和胎儿联系的第一个介质。第二,随着妊娠过程,胎盘开始发育并发挥功能。因此胎盘是母体和胎儿联系的第二个介质。从这个过程中,我们可以看出,子宫内膜组织在围着床期直到胎盘发挥完整功能前,对胎儿的发育起着至关重要的作用,同时它也扮演着一个承上启下的角色。
Cell Press:在过去的十年里,单细胞技术迅速发展,近年来空间技术也取得了显著进展。您认为这些技术将如何助力我们研究胚胎发育、疾病和肿瘤等过程?
杜鹏研究员:从单细胞问世以来,我们利用单细胞技术对早期胚胎、各种器官组织和疾病肿瘤的细胞组成、基因转录调控以及表观调控网络进行了非常详细的定义。随着近几年空间组学的发展,更加立体化地展示出细胞的空间定位和细胞之间的相互作用。
从这次的研究结果可以看出,结合单细胞空间组学技术,我们发现,胚胎发育异常可能不仅仅来自于细胞的分子水平的异常,细胞的异常定位同样可以导致细胞的功能失调,生命活动紊乱。因此利用好空间技术,可以为疾病和肿瘤的治疗提供新的思路策略。


