近日,山东大学生殖医学研究中心陈子江/赵涵/赵世刚等团队利用华大自主研发的时空组学技术Stereo-seq进行了卵巢单细胞纳米级空间RNA测序,以研究卵巢微环境(ovarian microenvironment,OME)在不同类型的肥胖下的变化。该研究提供了单细胞分辨率下卵巢细胞的全面动态空间图谱,揭示了OME中先前未知的空间复杂性及其在肥胖过程中的特定表达状态,为理解肥胖在OME中的生物学重要性提供了有价值的见解。
该研究2023年9月15日在SCIENCE CHINA Life Sciences发表。山东大学陈子江院士、中国科学院动物研究所高飞研究员、山东大学赵涵教授和赵世刚研究员为共同通讯作者,姜永辉博士和高雪莹博士为共同第一作者。山东大学为第一作者单位和通讯作者单位。以下是文章的详细解。

文章题目:Cellular atlases of ovarian microenvironment alterations by diet and genetically-induced obesity
发表时间:2023-09-15
发表期刊:SCIENCE CHINA Life Sciences
主要研究团队:山东大学、中国科学院等
影响因子:9.100
DOI:10.1007/s11427-023-2360-3
肥胖可能由遗传或环境因素引起,已被证明会对生殖系统造成严重损害。卵巢作为女性生殖系统中的重要器官,它由多种细胞组成,包括卵母细胞、颗粒细胞、黄体细胞、间质细胞等。这些细胞之间相互协同作用,共同维持着女性的正常生育能力。然而,肥胖会对卵巢功能产生诸多不利影响。因此,清楚的了解肥胖对卵巢微环境的影响对改善女性生殖健康具有重要意义。
利用Stereo-seq和snRNA-seq分别分析C57BL/6J野生型雌性小鼠(wild-type normal chow diet,NCD)、高脂饮食诱导的肥胖小鼠(wild-type high-fat diet,HFD)和瘦素基因敲除诱导的肥胖小鼠(Leptin-/- normal chow diet,OB)的卵巢样本。
1. Stereo-seq和snRNA-seq显示NCD、HFD和OB小鼠不同的卵巢细胞群
研究人员通过联合使用Stereo-seq和snRNA-seq,研究了肥胖对小鼠卵巢的影响(图1A)。小鼠卵巢包含不同发育阶段的卵泡,这些卵泡在空间上具有高度的特异性。为了准确定义存在的细胞类型,研究人员通过Stereo-seq共鉴定了八种细胞类型,包括颗粒细胞(granulosa cell,GC)、卵泡膜间质细胞(theca-interstitial cell,TIC)、黄体细胞、基质细胞、免疫细胞、上皮细胞、卵母细胞和红细胞(图1D)。结果表明,Stereo-seq和snRNA-seq鉴定的细胞簇标记具有良好的共性。例如,Inha、Fst和Gja1等基因在两个数据集中的颗粒细胞中都有特异性表达(图1E)。最后,研究人员根据整体的空间分析评估了这些细胞类型的相应空间位置(图1F),并描绘了单细胞分辨率下卵巢细胞的全景空间图谱。
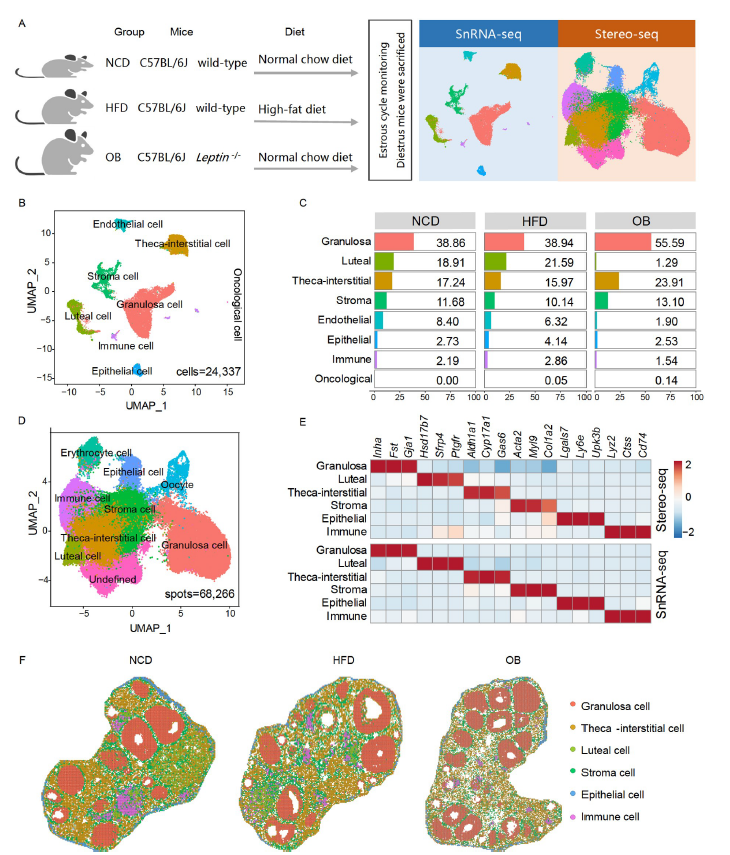
图1. 高脂饮食和瘦素缺失型肥胖对卵巢微环境的影响
GC是构成卵巢中最高比例的细胞,并且在卵泡发育过程中表现出相当大的变异性。基于上述描绘的卵巢单细胞空间图谱,研究人员确定了四个GC亚群,包括窦前卵泡(preantral follicle,PAF)GC、小腔卵泡(small antral follicle,SAF)壁层GC(mural GCs,mGCs),大腔卵泡(large antral follicle,LAF)mGCs和卵丘颗粒细胞(cumulus cells,CCs,图2A)。Stereo-seq中的GC重聚类识别了上述四个亚群,并且与snRNA-seq数据集中GC亚群标记基因的相关性高度一致(图2F),实现了GCs亚群在空间转录中的精准注释。
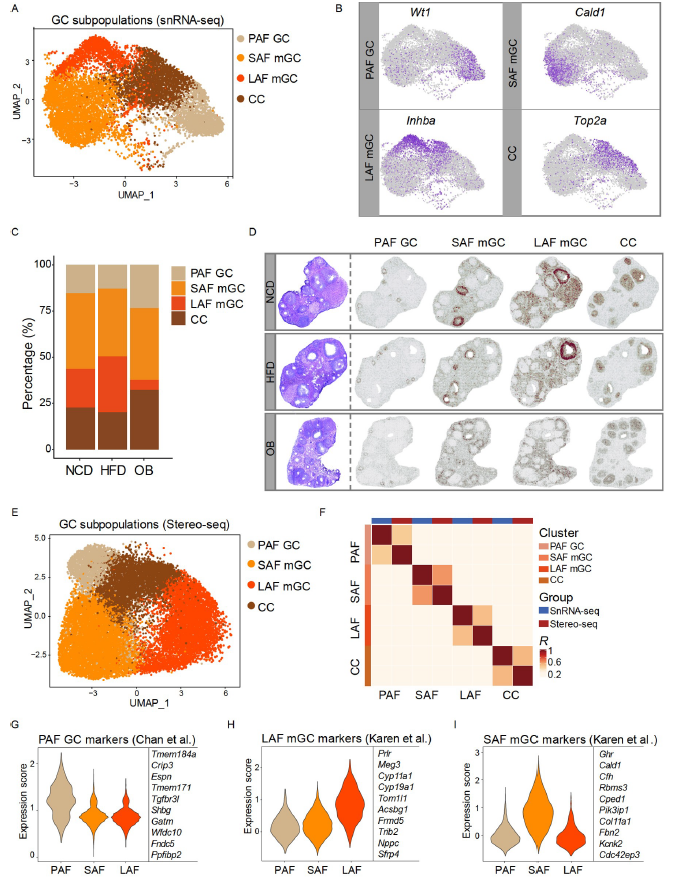
图2. 颗粒细胞亚群中卵泡时期特异性基因的表达模式和空间特征
利用Stereo-seq等技术得到的卵泡发育阶段特异GCs的稳健和精确的单细胞空间转录图谱,研究人员研究了肥胖对GC分化的影响,确定了九个在肥胖条件下发生显著变化的基因模块(图3D)。发现在GCs从小到大的分化轨迹中,肥胖引起了一些关键基因的变化,揭示了肥胖对mGC由小卵泡向大卵泡分化影响的分子机制。
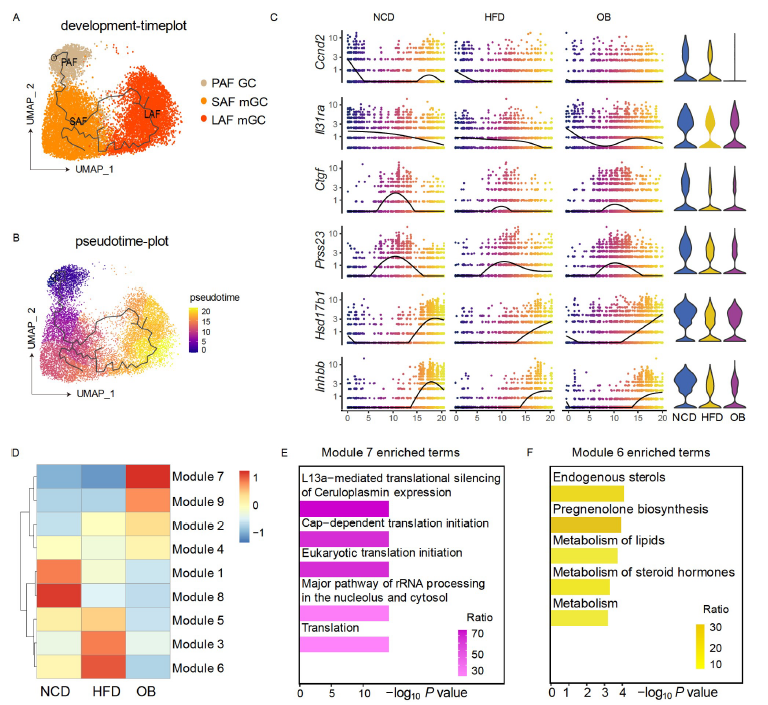
图3. 肥胖对mGC分化影响的基因表达谱动态研究
4. 促卵泡激素反应靶点在HFD小鼠有腔卵泡中增加而在OB小鼠中减少
正常的卵泡发育离不开促性腺激素,尤其是有腔卵泡的发生。研究人员进一步研究了肥胖小鼠促卵泡激素(follicle-stimulating hormone,FSH)调控靶基因的变化。通过Stereo-seq发现反式调节基因的基因集得分在HFD小鼠中较高,但在OB小鼠中相对较低(图4e)。为了进一步探索影响上述过程不同变化的驱动因素,研究人员进行了SCENIC分析,并确定了一系列显著改变肥胖的调节基因,包括经典转录因子Foxl2、Wt1、Gata4和Foxo1(图4F)。
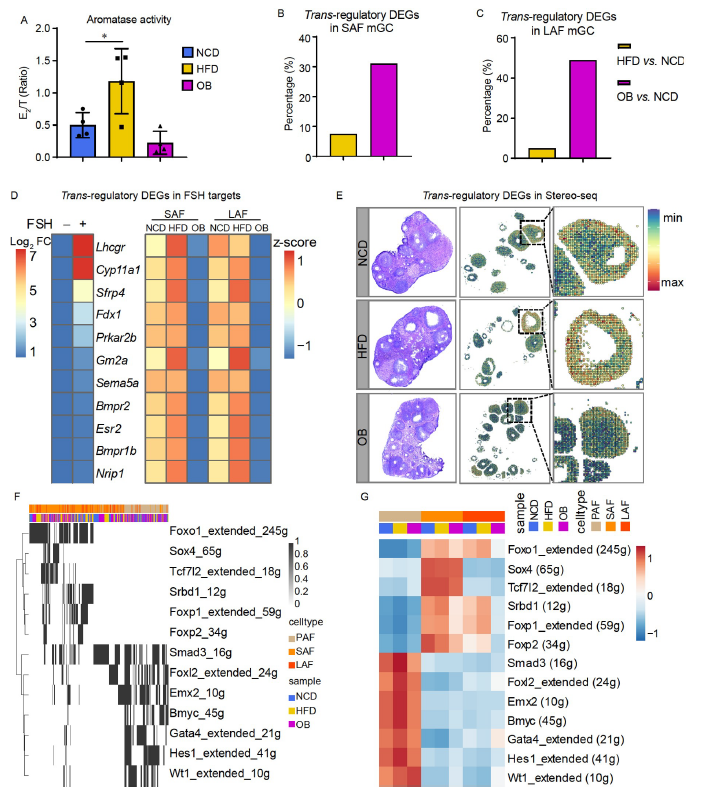
5. FOXO1在HFD和OB肥胖小鼠模型中的反向表达
得益于Stereo-seq,研究人员能够跟踪Foxo1及其靶基因在GC中的空间表达,由此观察到Foxo1和Cyp11a1的表达模式相反(图5A)。此外,还发现HFD小鼠的Foxo1阳性spots数量减少,而Cyp11a1阳性spots显著增加,促使黄体细胞的卵巢类固醇激素合成增强。相比之下,OB组小鼠的Foxo1阳性spots数量增加,而Cyp11a1阳性spots数量减少(图5B),表明HFD和OB小鼠在卵巢类固醇合成方面表现出完全相反的特性。
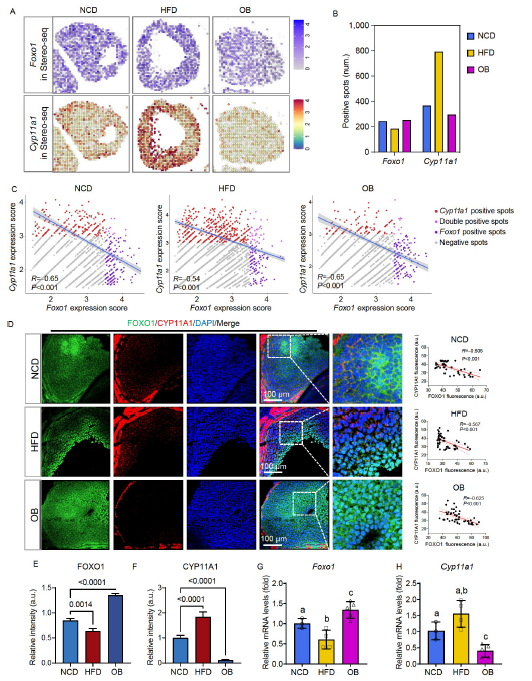
图5. Foxo1在HFD和OB肥胖小鼠模型中呈反向表达
利用获得的卵巢单细胞空间图谱,研究人员还确定了两个不同的TICs群体(T0和T1,图6A)。T0簇主要在NCD和HFD小鼠中表达,而T1簇主要在OB小鼠中表达(图6B)。此外,T0和T1标记基因组的空间表达表明,T0和T1都主要在卵巢髓质中表达。然而,NCD和HFD的表达谱相似,而OB小鼠表现出不同的表达谱(图6C)。在临床疾病方面,研究人员还结合了卵巢癌的两个单细胞测序数据进行了联合分析,在单细胞水平上表明了肥胖是卵巢肿瘤的高危因素。
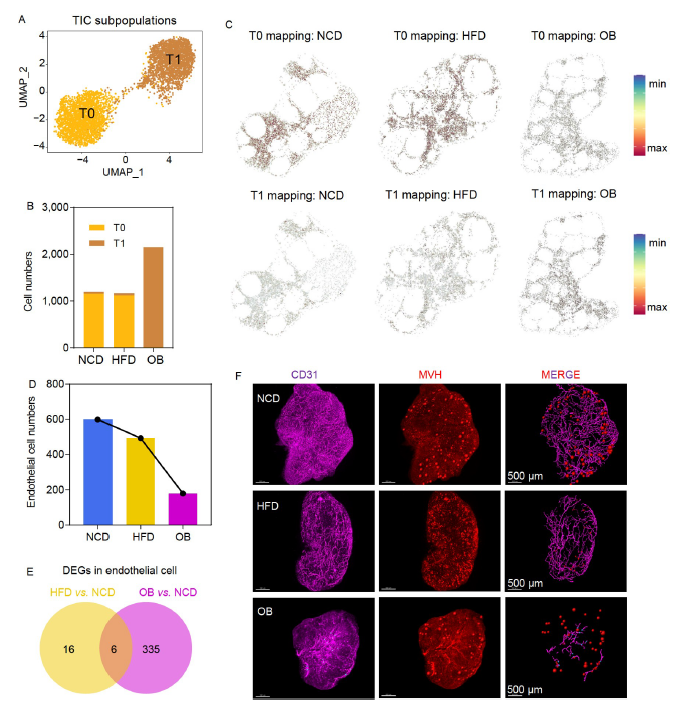
图6. 卵泡膜间质细胞和内皮细胞内转录和细胞多样性
该研究通过Stereo-seq空间分析结合snRNA-seq,对高脂饮食和遗传因素诱导的肥胖引起的OME差异改变进行了整体剖析,揭示了高脂饮食肥胖和遗传性肥胖对OME在许多方面的不同影响,极大地丰富了人们对不同类型肥胖如何影响OME的理解,并为后续关于肥胖和生育的研究提供了可参考的卵巢单细胞空间图谱。







