杭州华大生命科学研究院、深圳华大生命科学研究院联合广东省医学科学院、华南师范大学、武汉大学等多家科研单位,利用华大自主研发的高分辨率时空组学技术Stereo-seq,绘制了首个蝾螈端脑发育及再生的时空单细胞转录组图谱,鉴定了蝾螈端脑再生过程中的重要神经干细胞亚型(reactive ependymoglial cell, reaEGC),并比较了其状态与发育时期神经干细胞的相似性。该成果在2022年9月2日以背靠背封面文章的形式发表于国际顶级学术期刊Science,以下是第一作者魏小雨博士详细解读。

文章题目:Single-cell Stereo-seq Reveals Induced Progenitor Cells Involved in Axolotl Brain Regeneration
发表时间:2022-09-02
发表期刊:Science
主要研究团队:杭州华大生命科学研究院、深圳华大生命科学研究院、广东省医学科学院、华南师范大学及武汉大学
影响因子:63.714
DOI:10.1126/science.abp9444
研究背景
在脊椎动物中,大脑是一个重要且复杂的器官,控制着行为、情感、记忆等。包括人类在内的哺乳动物大脑,由于其再生能力有限,损伤后修复极具挑战性。而硬骨鱼、蝾螈等低等脊椎动物表现出了强大的器官再生能力,且蝾螈的大脑解剖结构与哺乳动物有一定的相似性,所以它是研究大脑再生的理想模型,对进一步了解哺乳动物大脑再生的内在局限性,以及未来中枢神经系统再生医学的发展至关重要。以往研究表明,室管膜胶质细胞(ependymoglial cells,EGCs)相当于哺乳动物的神经干细胞,在脑再生中发挥着重要作用。目前,在蝾螈和鱼类中只有少数EGC激活和脑再生的信号通路被证实,如Notch、FGF和Gata3。这些通路对大脑发育也会有调控作用,提示大脑再生可能与发育有相似之处。但再生的蝾螈大脑多大程度上可以再现胚胎发育时期的特征尚未确定,相关的分子机制仍不清楚。因此,需要对蝾螈脑发育及再生过程中不同时间阶段的细胞和分子功能进行更系统的表征,解析发育及再生转录组学动态变化特征,以促进对大脑再生分子机制的理解。
研究样本
墨西哥钝口螈(Ambystoma mexicanum)不同发育阶段的端脑样本:stage44(破膜后第一次进食)、stage54(前肢生长完成)、stage57(后肢生长完成)、青少年阶段(juvenile)、成年阶段(adult)、变态阶段(metamorphosis)。蝾螈端脑损伤处理后不同天数(days post-injury,DPI)的再生阶段样本:对照组(同juvenile1张)、2DPI(3张)、5DPI(3张)、10DPI(3张)、15DPI(4张)、20DPI(3张)、30DPI(1张)、60DPI(1张)。
以上脑切片均采用华大自主研发的Stereo-seq技术流程进行组织固定、细胞核染色拍照、组织透化及原位反转录、空间条码标记和测序文库构建及测序。
研究策略
利用时空组学技术Stereo-seq,绘制墨西哥钝口螈端脑发育及损伤修复过程中单细胞水平空间转录组图谱。结合生物信息学分析及ISH实验验证,在空间水平上系统解析蝾螈端脑细胞类型及对应脑区分布。并对不同发育阶段端脑比较分析,揭示蝾螈端脑主要细胞类型的转录组动态变化;利用基因模块(gene module)分析发育过程中神经干细胞(neural stem cell,NSC)、细胞周期(cell cycle)和蛋白质翻译(translation)相关模块基因活性的变化趋势。然后通过对脑损伤修复过程中不同阶段的数据分析,解析损伤侧与非损伤侧细胞类型在不同时间点分布差异以及细胞互作情况。此外,利用Dynamo、Monocle等算法推测损伤区域再生神经细胞谱系分化机制。最后,将脑发育数据与脑再生数据进行基因表达模式、RNA速率、伪时序及差异基因相关分子调控通路等比较分析,探究蝾螈脑再生与发育之间潜在的神经形成分子调控机制的异同。
研究成果
1. 蝾螈成年端脑单细胞分辨率空间转录组图谱
研究人员首先解析了成年蝾螈端脑转录组特征。借助华大纳米级分辨率时空组学技术Stereo-seq,实现了蝾螈成年端脑空间转录组建库测序,并进一步利用细胞分割完成单细胞水平的空间转录图谱的构建(图1A、B)。通过考虑空间距离聚类发现,其端脑细胞被划分为包括脑室区(VZ)在内的六个区域,分别与蝾螈端脑的解剖区域相对应(图1C)。更精细的无监督聚类确定了16种细胞类型,包括三个位于VZ区的EGC类群(图1F、G)。GO分析结果表明,高表达核糖体相关基因的ribEGC可能具有活跃的增殖特性(图1H)。
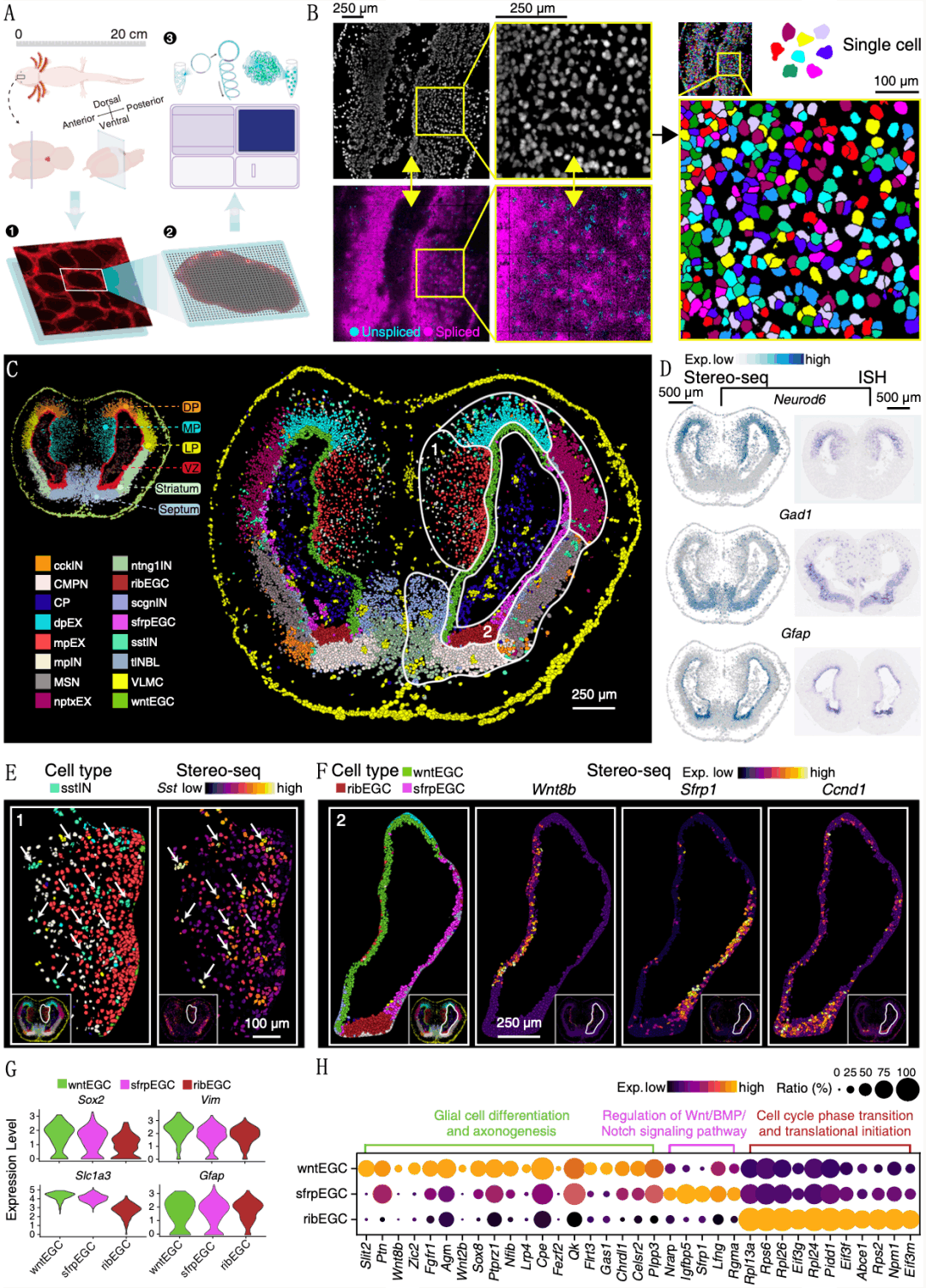
图1 成年蝾螈端脑时空图谱
2. 蝾螈端脑各发育阶段EGC类群动态变化
为了阐明蝾螈端脑发育的细胞和分子动态变化特征,研究人员对处于不同发育阶段(stage44、54和57,青少年阶段,成年阶段,变态阶段)的蝾螈端脑进行采样,获得了对应阶段端脑的空间单细胞发育图谱(图2A)。通过聚类分群及细胞类型注释,确定了33种细胞类型,其中包括13种表达祖细胞和分化细胞等标记基因的未成熟/过渡阶段的细胞类型(图2A)。研究人员重点关注发育阶段的EGC类群,发现了表达早期发育基因的dEGC出现在stage44,最终在青少年阶段消失并特化成三种EGC的亚型(图2B)。
为了表征EGCs在发育过程中的分子动力学,研究人员评估了定义神经干性、细胞周期和蛋白质翻译活性的三个基因模块的表达,揭示了发育早期VZ区EGC增殖和分化潜能强,而在发育后期这些模块的高表达细胞减少,并限制在VZ的腹侧,也就是ribEGC(ribsomal ependymal gilal cell)所在区域(图2C、1H)。
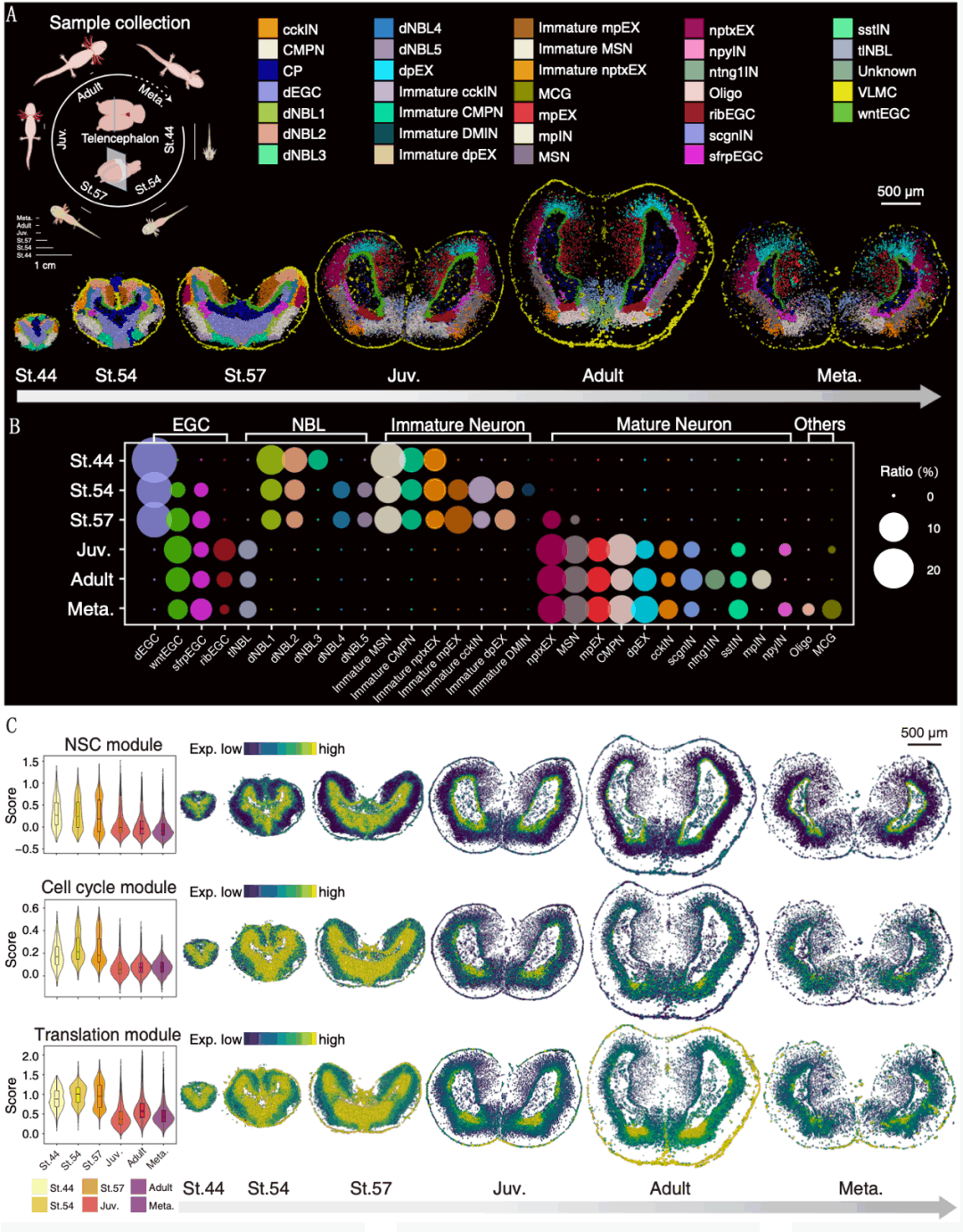
图2 蝾螈端脑发育时空图谱
3. 端脑再生过程细胞动态变化与细胞通讯
蝾螈端脑损伤再生过程中涉及一系列复杂的空间位置特异的细胞类型动态变化与分子调控事件。为了探究这些问题,研究人员通过构建青少年阶段蝾螈端脑损伤模型,获取了来自8个不同损伤再生阶段的端脑单细胞时空图谱(图3A、B)。通过细胞类型注释发现,在28种细胞类群中有8种细胞类型是在再生阶段新增的(图3B)。切片的形态学观察显示,蝾螈脑损伤在30 d内即愈合,在60 d时所有细胞类型已经恢复(图3B)。在损伤后2~15 d,一类高表达C1qb和Ctsl基因的小胶质细胞和一类高表达Vim等神经干细胞标志基因的激活态EGC(reaEGC)高度富集,前者可能与损伤后的免疫反应有关,而后者可能对再生过程有促进作用。通过拟时序分析和基因共表达分析,研究人员发现reaEGC高表达与神经前体细胞增殖和分化相关转录因子,以及伤口愈合反应通路相关基因。
此外,研究人员还发现了一群在损伤早期(2~5d)伤口附近出现的神经元类群,其与对侧相同脑区位置的nptxEX(Nptx+ lateralpallium excitatory neuron)表达特征不同,而更类似未成熟的神经元,并命名为损伤刺激性神经元(wound stimulated neuron,WSN)(图3E、F)。考虑到其空间位置分布和在损伤早期出现的特点,研究人员推测WSN是由同位置的nptxEX重塑形成的,暗示在蝾螈脑损伤过程中存在受损神经元恢复的可能性。
在局部微环境中,细胞通讯对协调再生反应至关重要。研究人员进一步根据考虑空间位置的聚类分析,将损伤后2d的端脑切片分为10个区域,并预测每个区域可能的配体-受体相互作用。大多数检测到的相互作用配体受体对位于VZ中,并参与增殖、细胞迁移和细胞外基质重塑,表明reaEGC对蝾螈端脑再生的促进作用。Tnc以及Sdc1在伤口周围有强烈表达,并且在reaEGC和WSN中有较高的相互作用(图3G、H)。其中,肌腱蛋白C(Tenascin-C,TNC)是一种存在于神经源性生态位中且在组织修复与再生中必不可少的糖蛋白;SDC1(syndecan 1)也被证明是损伤诱导并参与神经发生的关键蛋白。这表明了reaEGCs在损伤神经元再生过程中起调节作用(图3B、G、H)。
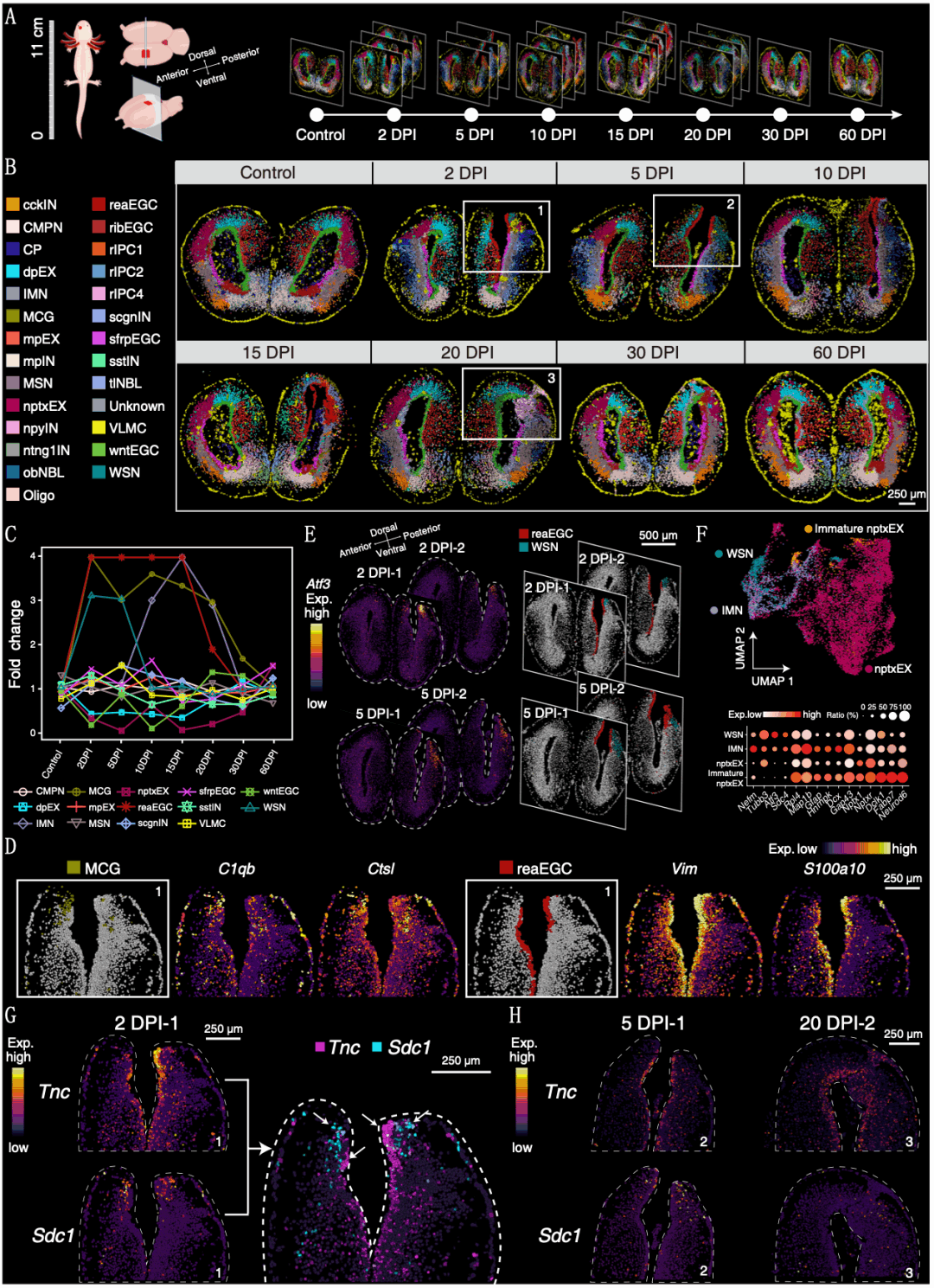
图3 蝾螈端脑再生的时空图谱
4. 端脑再生过程中神经形成的空间细胞谱系
为了验证reaEGC修复丢失神经元这一假设,研究人员在再生阶段15DPI时,沿着首尾轴从伤口中心向尾侧做了4个连续切片,并进行Stereo-seq分析。结果显示,在15DPI-4切片中观察到位于reaEGCs和不成熟神经元(immature neuron,IMN)之间的再生特异性细胞群,它们同时表达reaEGCs和IMN的标记基因(图4A、B),并将这种细胞群命名为rIPC1。这表明可能存在潜在的细胞状态转换过程,即reaEGC-rIPC1-IMN-nptxEX。为了进一步验证这一过程,研究人员将15DPI-4分成三个区域,并进行RNA速度和Monocle拟时序分析(图4C~E)。结果均支持沿着reaEGC-rIPC1-IMN-npxEX轴的谱系转换过程。在15DPI-2和-3切片中也观察到了类似的转变。然后,研究人员分析了沿着拟时序轴的基因表达的变化,观察到与潜在转换相匹配的基因表达变化和基因功能(图4F、G)。紧接着,研究人员对2DPI到60DPI的再生相关细胞进行Monocle3拟时序轨迹分析,结果也支持reaEGC-rIPC1-IMN-nptxEX的模式(图4H)。最后,研究人员进一步在空间数据中展示了拟时序轨迹结果(图4I)。
综上所述,蝾螈端脑再生过程中存在着一种细胞谱系转换关系,即reaEGCs增殖以覆盖伤口,同时转换或分化为中间态和成熟神经元以重建损伤的脑组织。
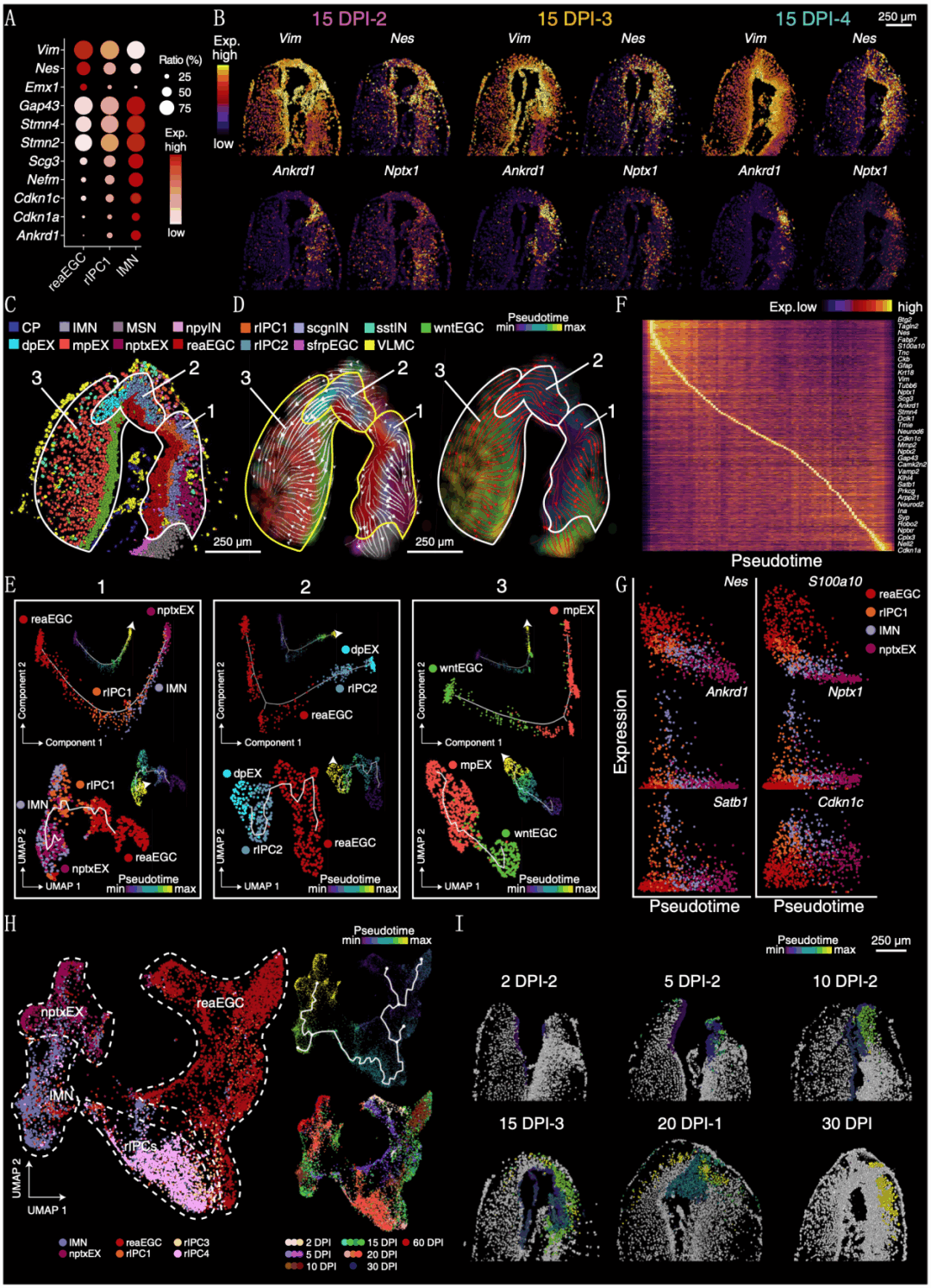
图4 蝾螈端脑再生过程中的细胞谱系转变
5. 端脑发育与再生过程中神经发生的比较
经上述分析,研究人员在再生过程中发现了潜在的细胞谱系转变轨迹,这与大脑的发育过程相似。那么再生与发育过程究竟有什么异同?接下来研究人员系统比较了这两个过程以探究它们的关系。首先,研究人员发现发育阶段Stage57和再生阶段15DPI-4的空间结构具有高度相似性(图5A、B),这表明在损伤诱导的再生过程中,可能重现了神经元的发育过程。为了进一步验证这种可能性,研究人员计算了发育阶段Stage44、Stage54、Stage57、青少年阶段和再生阶段15DPI-4中所有神经干细胞EGCs的相关性,结果显示,相对于其他EGC类型,reaEGCs的基因表达特征与Stage57的dEGC基因表达谱最为相似(图5C)。接着,研究人员分别对端脑再生与发育切片进行RNA速度分析和Monocle分析,发现在发育和再生过程中成熟神经元的形成具有相似的谱系转变轨迹,均是从EGCs到IPC,再到未成熟神经元和成熟神经元(图5F、H)。最后,研究人员通过对比发育和再生的分子表达特征,鉴定了再生与发育中相似及差异的相关通路特征(图5I、J)。
总的来说,蝾螈端脑时空组学数据表明,脑再生在一定程度上是重启的发育过程,但也有其独特的特点。
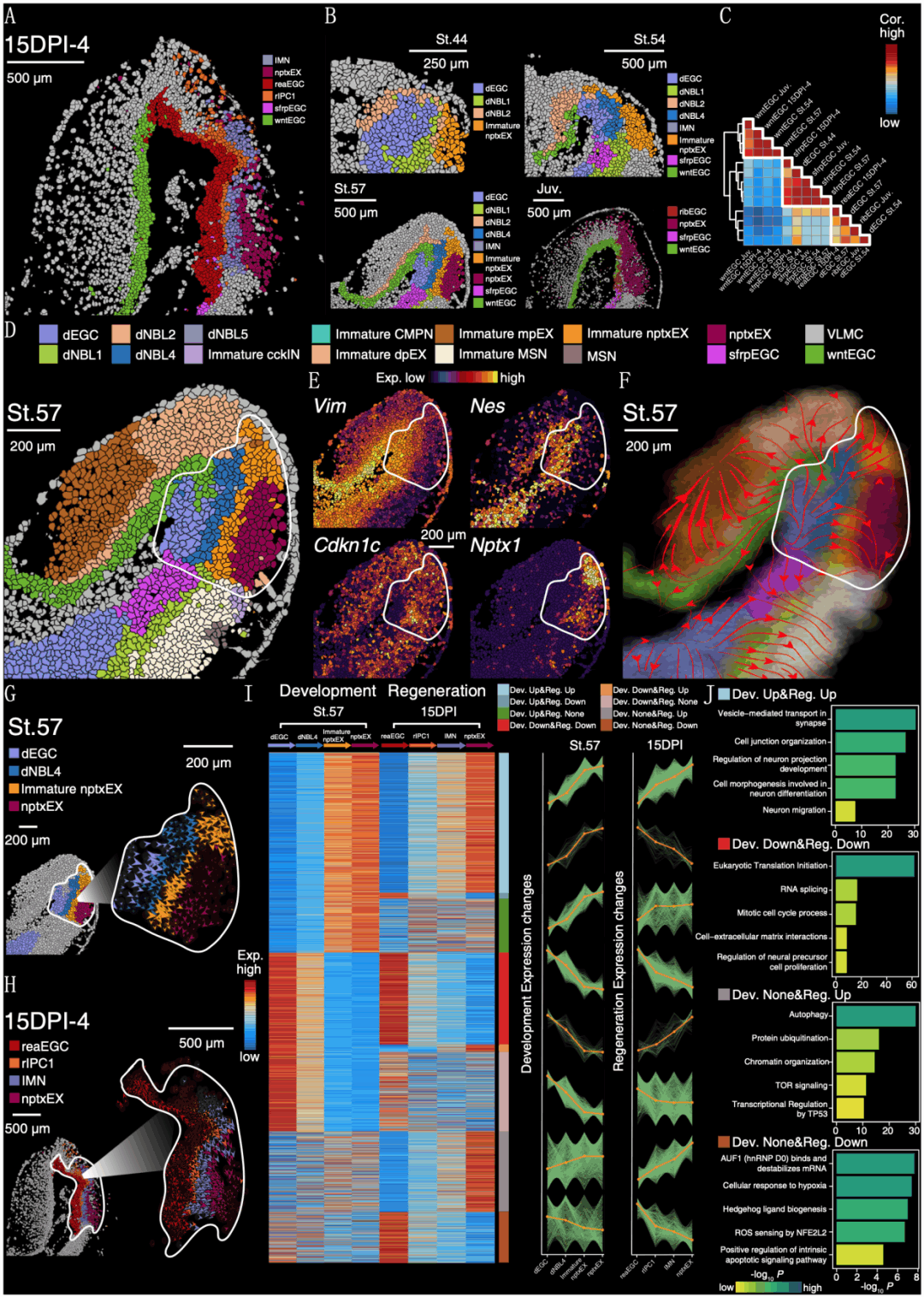
图5 蝾螈端脑发育与再生过程中神经元形成的比较
总结
本研究通过华大自主研发的高分辨率时空组学技术Stereo-seq,构建了单细胞分辨率的墨西哥钝口螈端脑原位再生和发育的空间转录组图谱。通过Stereo-seq实现了单细胞分辨率的成年蝾螈端脑脑区的分布和细胞类型的绘制,鉴定了成年蝾螈端脑有wntEGC、sfrpEGC、ribEGC三种EGC亚型,且ribEGC维持高度增殖状态。通过分析发育空间组学数据鉴定了与发育相关的EGC亚型dEGC,其在Stage44出现,而在青少年阶段之后消失。更有意义是,通过分析再生的空间转录组数据,发现蝾螈端脑损伤早期出现且与再生密切相关的神经干细胞亚型reaEGC。通过脑损伤的拟时序分析,发现神经元再生过程中的细胞谱系空间动态变化规律,即reaEGC作为祖细胞分化成IPCs,再分化为未成熟的神经元、成熟神经元。与之对应的是,发育过程中也发现类似再生的4种细胞类型分化过程。最后,确认了蝾螈端脑发育和再生的细胞分化存在一定的相似之处,同时也有各自特异的分子调控通路。
综上,该研究首次绘制了蝾螈端脑损伤再生和发育单细胞分辨率的时空转录组图谱,探究创伤修复、组织再生及细胞分化机制,并发现与损伤再生密切相关的细胞类型reaEGC,深化了对机体组织器官自我修复与原位再生的认识,对人类神经系统损伤修复或退行性疾病的治疗及再生医学应用具有关键性的指导促进意义。
本研究中提供的数据:
Stereo-seq数据集获取网址:https://db.cngb.org/stomics/artista/。
本研究原始数据通过CNSA数据库获得,数据编号为CNP0002068;分析代码获取网址:https://github.com/BGI-DEV-REG/ARTISTA。
作者:魏小雨






