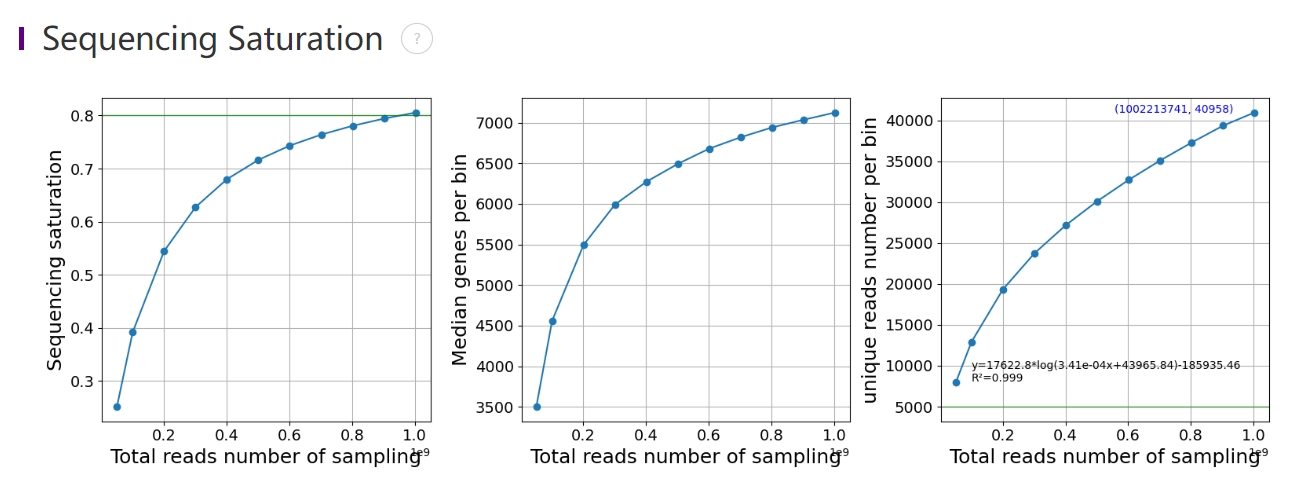
细胞分割的效果受到显微镜拍照的情况和分割算法等多重因素的影响。拍照时如果存在组织过曝、模糊等因素,会影响算法识别细胞,导致无法分割。对于密集区域本身清晰度不够,并且可能存在细胞重叠的情况,那么也会导致算法难以识别。如果图像中组织不同区域局部亮度不均匀、或者存在实验导致的拖尾、背景存在杂质等情况,也会导致分割错误。(部分示例见下方)详细信息请查阅《Stereo-seq 空间多组学技术成像指南》。
从算法本身来讲,因为分析流程的自动分割算法是基于人工标注的数据集,学习训练而来,所以一些非常少见的细胞形态未能涵盖进数据集中,也可能会导致算法无法准确识别出细胞。
如果自动算法分割效果不佳,可以尝试使用 StereoMap 桌面端图像处理软件进行手动调整,也可以尝试用其他算法重新分割,将分割后的 .tif格式的二进制细胞掩膜文件重新导入 StereoMap 做后续分析。详细操作请查阅《StereoMap 用户手册》>图像处理指南>核染色图像>#第四步:细胞分割。
注:每个染色类型推荐的分割算法可参考:CellBinDB:大规模多模态数据集助力细胞分割模型开发与评估