宫颈癌是危害全球女性健康的第四大癌症。据统计,2018年世界范围内新增宫颈癌病例接近57万,其中我国的新增病例超过10万。
世界卫生组织(WHO)于2020年正式发布《加速消除宫颈癌全球战略》,这是全球194个国家首次承诺消除一种癌症。未来数十年内,对宫颈癌前病变或癌症病人的有效管理和治疗,仍是医疗体系的工作重点之一。
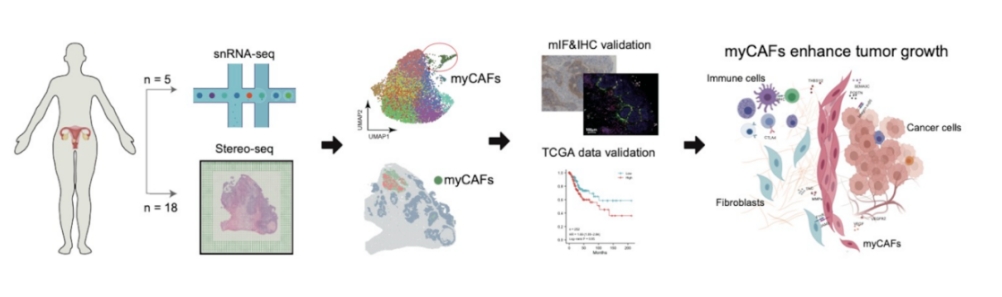
近日,国际期刊Advanced Science 发表了深圳华大生命科学研究院与华中科技大学医学院附属同济医院、重庆西南医院的合作研究成果,该研究使用华大时空组学Stereo-seq技术,首次在宫颈鳞癌临床组织中鉴定了一类促癌的肿瘤相关肌成纤维细胞(myCAFs),并深入诠释其功能。此类细胞有望成为治疗晚期宫颈鳞癌的潜在靶标,有助于开发新的预后和治疗方法,对宫颈鳞癌临床用药研发具有科学指导意义。

Advanced Science 官网截图
宫颈癌主要由高危型人乳头瘤病毒(HPV)的持续感染引起,其中大多数为HPV16阳性的宫颈鳞癌。原发性宫颈癌患者通过子宫切除术可以获得良好的预后,但是晚期宫颈癌患者的5年总生存率并不理想。目前,化疗和放疗仍然是转移性或复发性宫颈癌的主要姑息治疗方法。
《加速消除宫颈癌全球战略》概述了三个关键措施:疫苗接种、筛查和治疗。其中治疗方面所有国家或地区在2030年需实现的目标为:90%确诊宫颈疾病的妇女得到治疗。
近年来,免疫疗法为晚期癌症的治疗带来了新的希望,但不幸的是,晚期癌症对免疫疗法的总体反应率偏低,仅30%以下的病人能够得到有效治疗。因此,进一步了解宫颈鳞癌的免疫状况,尤其是肿瘤微环境中的免疫抑制状态,将帮助我们更好地解释这一现象,改善晚期宫颈癌的治疗策略,助力消除宫颈癌。
本次研究团队通过采集20名女性的宫颈病变组织,结合华大自主研发的时空组学技术Stereo-seq、单细胞及免疫组化等技术,对宫颈鳞癌的微环境进行解析。研究团队在宫颈鳞癌的临床组织中鉴定了肿瘤相关肌成纤维细胞,并探讨其促进癌症生长的功能。

肿瘤相关肌成纤维细胞(下称“myCAFs”),可以简单理解为宫颈癌的“帮凶”。本次研究Stereo-seq数据显示,myCAFs能够聚集在肿瘤周围,形成一道物理屏障,阻止免疫细胞进入癌灶,协助肿瘤细胞对抗人体的免疫系统;同时,分泌细胞因子促进肿瘤细胞增殖、血管生成及重塑细胞外基质,进而促进癌细胞不断生长及转移。
为进行相关验证,研究团队通过TCGA公共数据库获取252例宫颈鳞癌数据,基于转录组数据的分析表明,myCAFs特征基因较高表达时,宫颈鳞癌患者的生存率较低。在历史病理样本中,约20%的样本在癌灶外基质高表达myCAFs的标记蛋白,且表达水平越高,癌灶体积越大,淋巴结转移程度越高。这些证据说明,myCAFs可能促进癌灶生长及转移。
那么,在应用免疫疗法时,是否可以针对myCAFs进行杀伤或抑制其功能,进而让患者得到更好的治疗效果?
为了进一步探究myCAFs是否会影响宫颈鳞癌病人对免疫疗法的敏感性,研究团队使用公开数据,对myCAFs特征基因表达水平与临床评估免疫疗法敏感性指标进行相关性分析。研究结果均表明,myCAFs与宫颈鳞癌对免疫疗法的耐受性正相关。
myCAFs的促癌特性有望为宫颈晚期癌症预后及治疗提供新靶标。在使用免疫检查点阻断疗法时,同步杀死myCAFs或抑制其功能,可能会得到更好的疗效。而myCAFs的特异基因在癌症进展中发挥的功能及临床价值也值得进一步探究。此外,该研究还揭示了HPV基因在癌灶的表达情况以及肿瘤代谢与免疫反应强度之间的关联。整体而言,该研究为宫颈鳞癌的病毒学、细胞学和免疫学特征提供了高分辨率的观测数据,将有助于开发新的预后和治疗方法。
华中科技大学医学院附属同济医院吴鹏教授、深圳华大生命科学研究院徐讯研究员、李俊桦研究员,及重庆西南医院王延洲副教授为论文共同通讯作者。深圳华大生命科学研究院欧芷华博士、邱嘉颖、任陪娣、陈东升博士和王家轩,华中科技大学医学院附属同济医院的林诗通和丁文成博士为论文共同第一作者。项目严格遵照伦理规范开展,相关数据已完成中国人类遗传资源信息开放使用备案。
参考文献:
1. WHO. A cervical cancer-free future: First-ever global commitment to eliminate a cancer. https://www.who.int/news/item/17-11-2020-a-cervical-cancer-free-future-first-ever-global-commitment-to-eliminate-a-cancer (2020).
2. Ou, Z. et al. Single‐Nucleus RNA Sequencing and Spatial Transcriptomics Reveal the Immunological Microenvironment of Cervical Squamous Cell Carcinoma. Advanced Science 2203040 (2022).
3. Chen, A. et al. Spatiotemporal transcriptomic atlas of mouse organogenesis using DNA nanoball-patterned arrays. Cell 185, 1777–1792 (2022).
原文链接:http://doi.org/10.1002/advs.202203040



