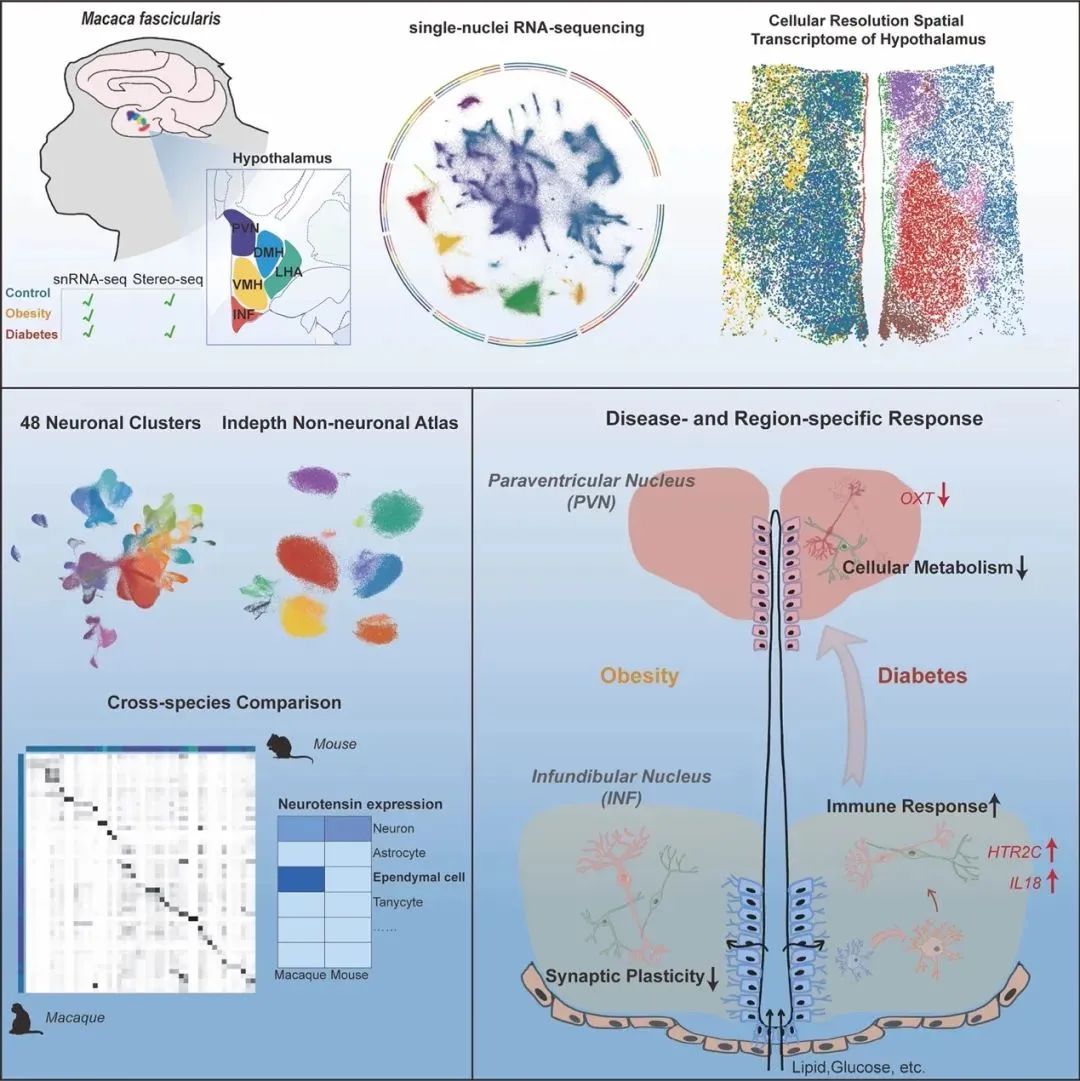
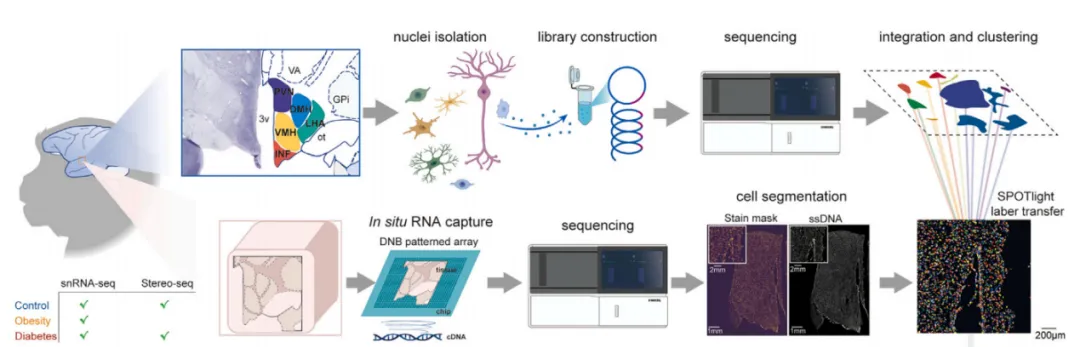
图1A snRNA-seq和Stereo-seq的实验设计和工作流程图
为了进行单核RNA测序(snRNA-seq)和空间转录组测序(Stereo-seq),研究人员将下丘脑显微切割成5个核团,或将其冷冻切片放置于Stereo-seq DNA纳米球(DNA nanoball,DNB)阵列芯片上(图1A)。经过筛选和质量控制,最终确定了465,632个高质量细胞,并将其划分为11种主要细胞类型。进一步根据关键神经递质或神经肽的表达将神经元分为4种主要神经元亚型,包括谷氨酸能、GABA能、组胺能和催产素能神经元。同样的,研究人员利用已知的细胞类型特异性标记基因将非神经元细胞分为7种主要细胞类型(图1B)。
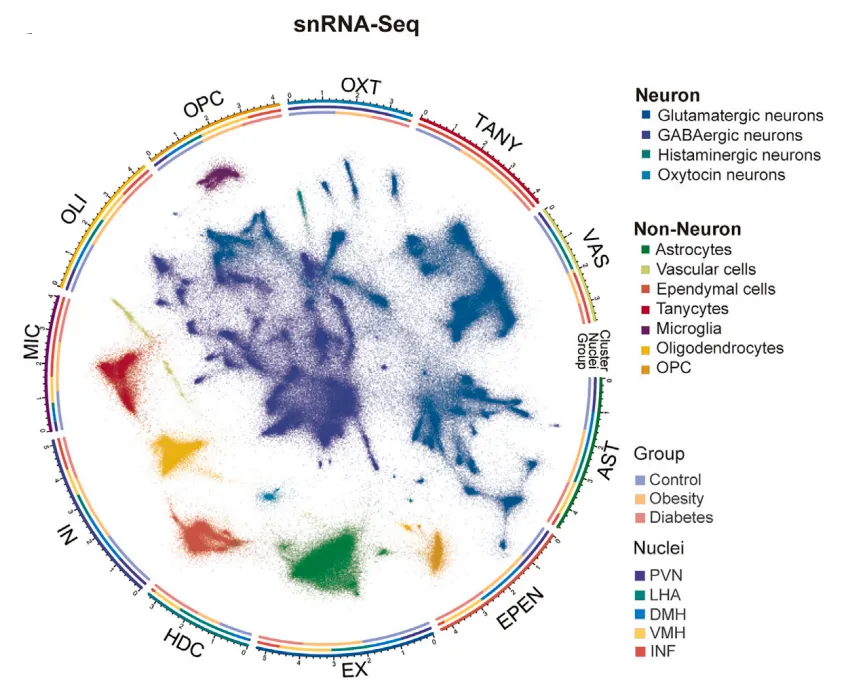
图1B 食蟹猴下丘脑的465,632个细胞的无监督聚类分析
研究人员利用Stereo-seq芯片(带有约220 nm直径的spots)原位捕获了单细胞转录信息。为了说明这些细胞类型的空间位置,研究人员从分割的细胞中对细胞类型进行了注释(图1A)。最终的研究结果表明,许多细胞类型在不同的下丘脑区域有特定的空间分布(图1C),比如伸展细胞(tanycytes,TANY,枢神经系统中一种主要位于第三脑室底部腹侧壁和正中隆起处室管膜上的特殊分化的胶质细胞)更多地存在于下丘脑弓状核,也称漏斗核(infundibular nucleus,INF)中,而催产素神经元则主要局限于下丘脑室旁核(paraventricular nucleus,PVN)中。
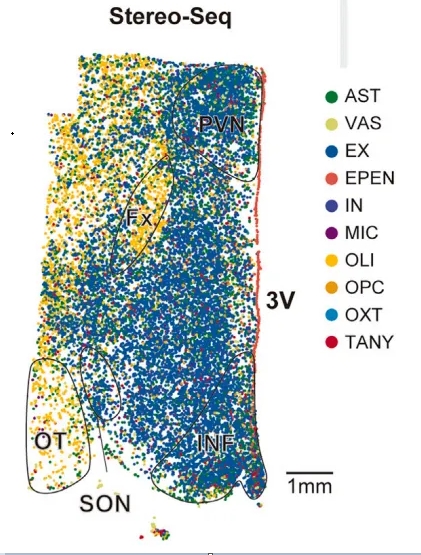
图1C 下丘脑各细胞类型的空间分布
为了进一步探索下丘脑的空间功能异质性,研究人员通过Hotspot揭示了由共享转录因子或调节子集共同调控的基因调控网络(图1D、E)。在非神经细胞中观察到了不同疾病状态下(肥胖或糖尿病)细胞类型的轻微变化,突出了神经胶质细胞对能量平衡被破坏的响应的显著敏感性(图1F)。
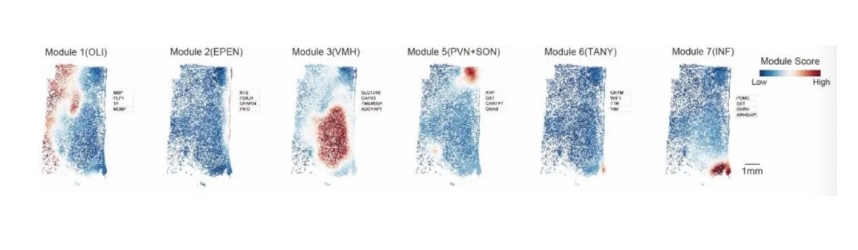
图1D Stereo-seq切片的基因模块
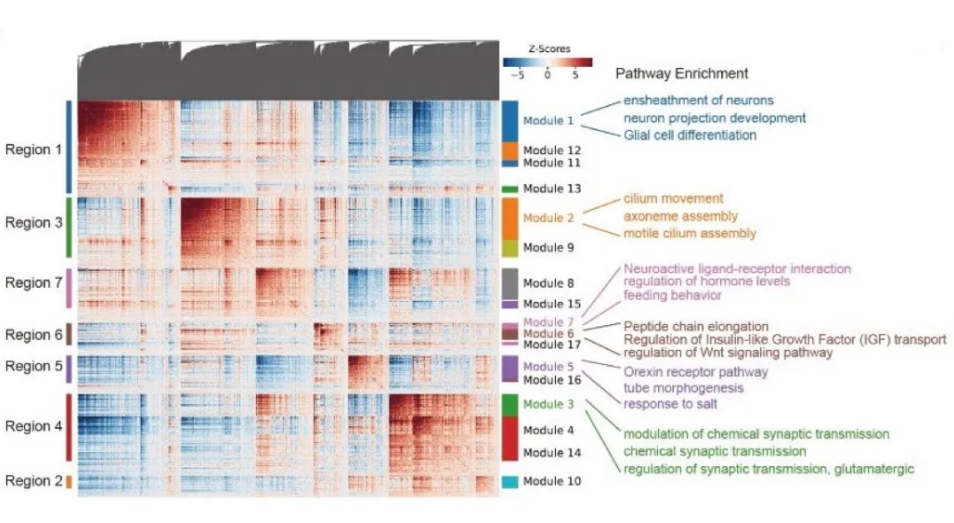
图1E Heatmap显示具有显著空间自相关的基因根据成对空间相关性分组到不同的模块
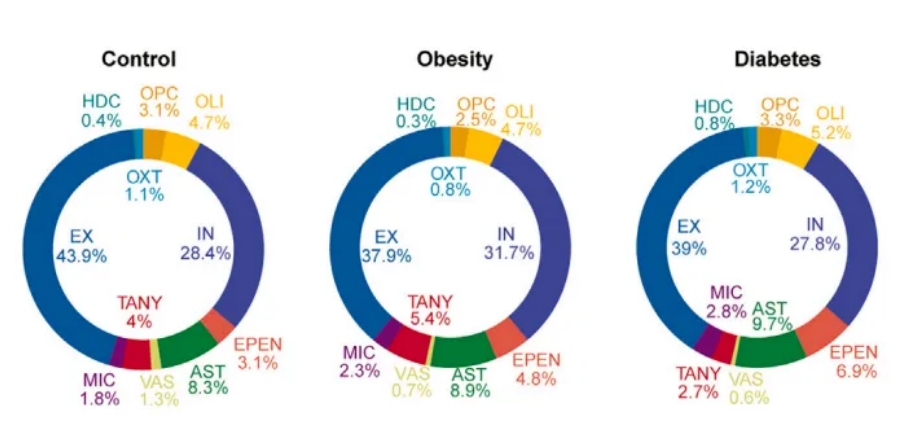
图1F 实验组及对照组的每种细胞类型的占比
总之,结合snRNA-seq和Stereo-seq,研究人员分析了约50万个细胞,提供了一个全面的单细胞和空间基因表达图谱,为进一步的OB和DB的分子变化研究提供了有价值的参考信息。
2. 单细胞空间转录组图谱揭示下丘脑神经元亚型分类和空间组织结构
在对332,130个神经元进行无监督聚类后,研究人员观察到48种具有不同基因表达特征的亚群(图2A),发现下丘脑包含许多在解剖和功能上不同的结构和核团。
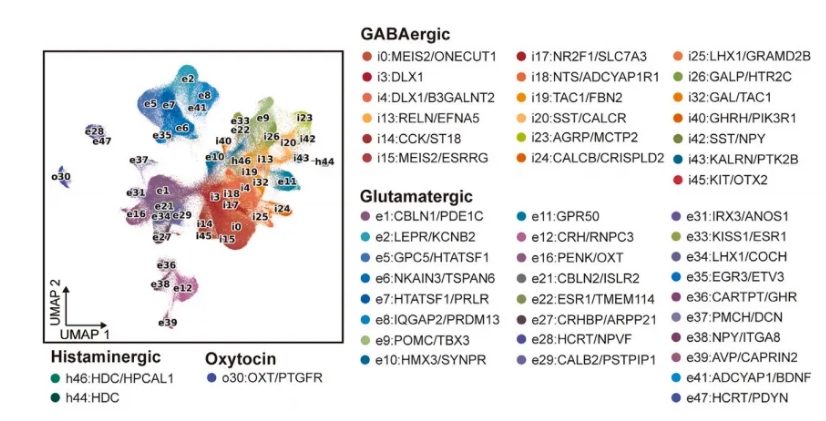
图2A 下丘脑神经元再聚类
结合来自snRNA-seq的全面基因图谱和Stereo-seq数据的单细胞空间信息,研究人员进一步探讨了这种异质性,发现大多数神经元集群,特别是那些表达神经肽的神经细胞群,显示出离散位置(图2B,2C)。
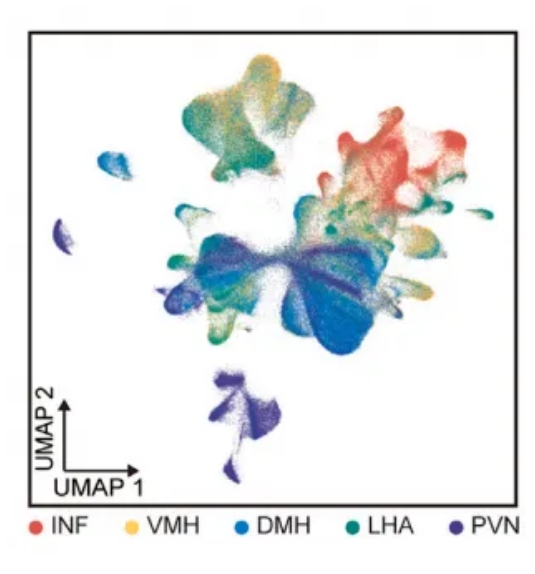
图2B 下丘脑核团UMAP可视化
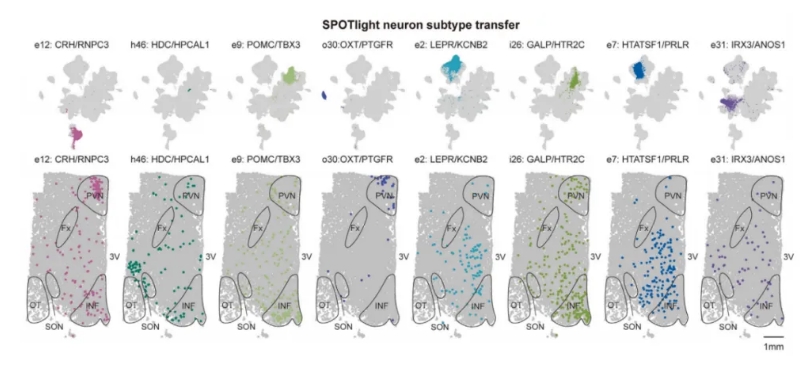
图2C UMAP可视化细胞群(上)和Stereo-seq分析(下)的空间分布图
与此一致的是,来自SPOTlight标记转移的Stereo-seq数据显示了这些细胞群在核团中的不同空间分布(图2C)。此外,主要标记基因也显示出在下丘脑的不同空间表达(图2D)。
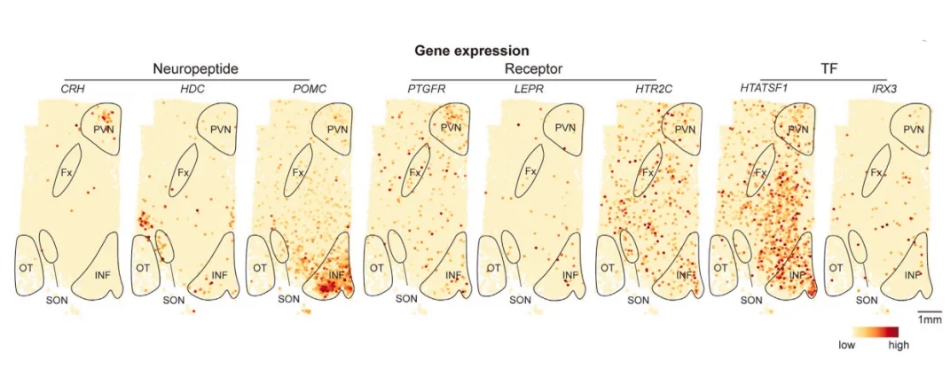
图2D 标记基因的空间表达模式图
总之,这些发现提供了对下丘脑单细胞空间多样性的新视角,这些信息是下丘脑核团功能特化研究的基础。
3. 单细胞空间转录组图谱揭示下丘脑对肥胖和糖尿病的差异性转录变化
以往的研究已经表明,下丘脑中不同的神经元亚型与特定的代谢调节有关。在该研究中,研究人员发现,受肥胖和糖尿病影响最强烈的脑区为INF。其中相比于肥胖,糖尿病在各个细胞类型中呈现更强烈的转录水平变化,包括PVN。此外,尽管INF和PVN神经元对代谢功能紊乱最为敏感,但它们在对糖尿病的响应上显示出了不同的分子变化(图3)。具体而言,INF神经元呈现出升高的炎症免疫反应网络,并涉及多种细胞类型,而PVN则显示出抑制性细胞代谢和活动。因此,这些结果提供了直接的分子证据,准确定位了IFN神经元-PVN回路在维持能量平衡中的重要作用,并强调了这两个核团对于开发更有针对性的代谢紊乱治疗方法的差异性响应。
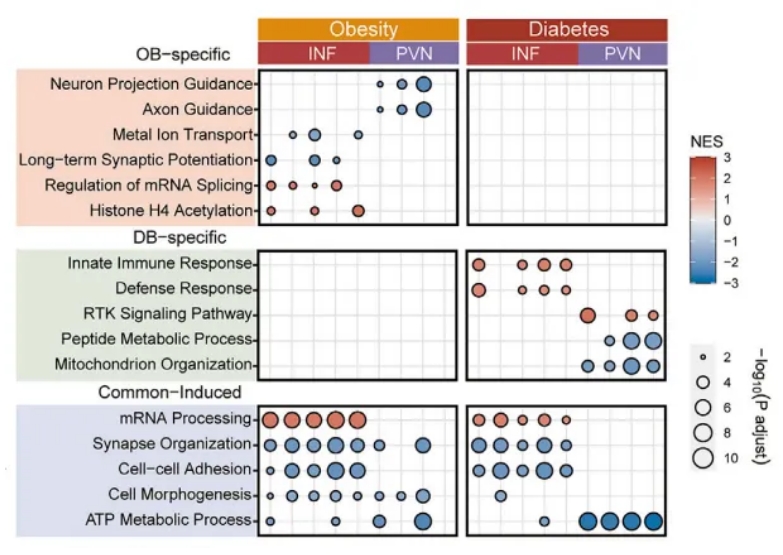
图3 实验组下丘脑不同区域的差异表达基因点图
此外,通过之前定义的遗传标记,研究人员检测到TANY的两个亚型(α和β)之间存在明显的转录组差异(图4F)。Stereo-seq进一步揭示了α和β亚型沿第三脑室自上而下的独特分布(图4G)。
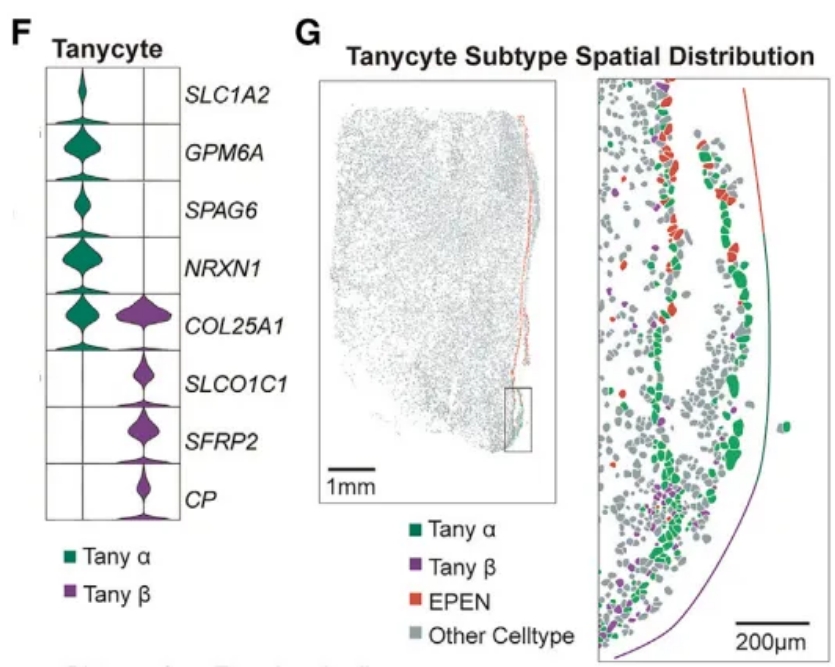
图4F, G 伸长细胞亚群的标记基因表达图谱及空间分布
作为大脑中的常驻免疫细胞,小胶质细胞(microglia,MIC)对中枢神经系统的正常功能和健康起着至关重要的作用。最近的研究表明,MIC在发育和疾病进展过程中表现出高度异质性。在该研究中,研究人员鉴定了两种MIC亚型(Micro-1和Micro-2,图4I)。
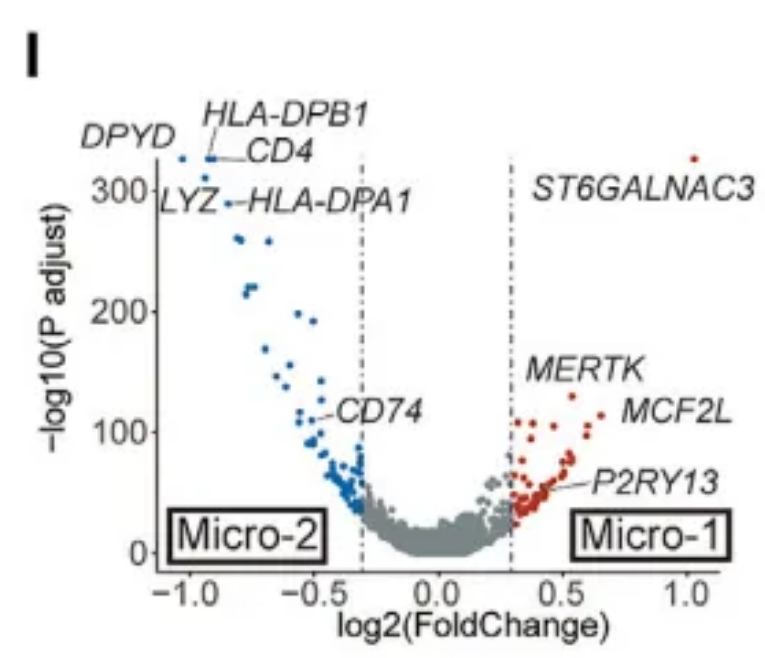
图4I MIC亚群的差异表达基因火山图
值得注意的是,与对照组相比,通过Stereo-seq,研究人员观察到DB组的Micro-2在空间上从第三脑室向脑实质迁移(图4L和4M)。鉴于MIC在下丘脑免疫中的关键作用,DB诱导的MIC活化和迁移可能会改变参与调节全身代谢的神经元的功能。
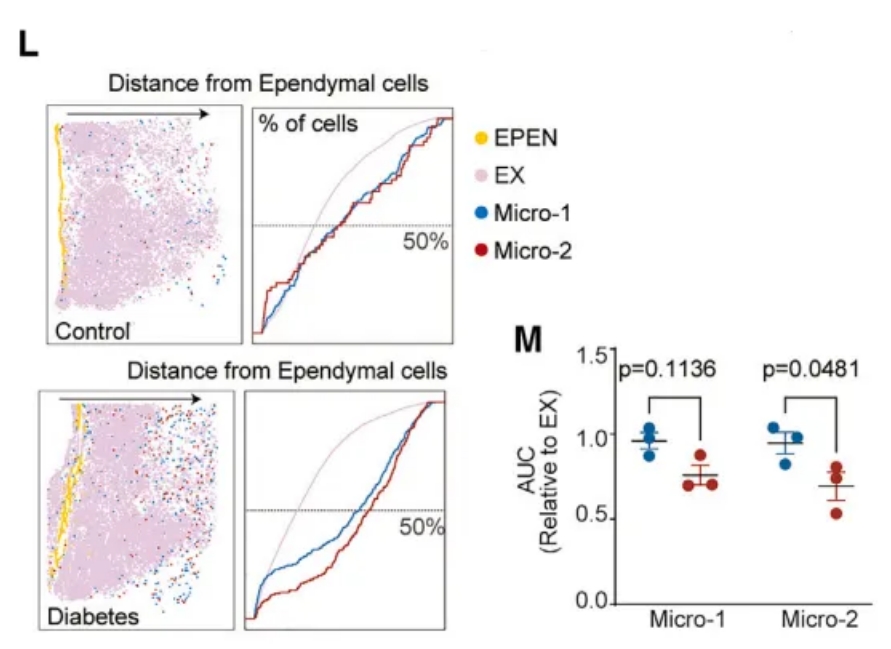
图4L, M Stereo-seq显示糖尿病组的细胞迁移偏好
Stereo-seq结合scRNA-seq的应用极大地促进了科研人员对脑细胞类型的时空多样性的理解。在该研究中,研究人员通过直接检测465,632个细胞中的多种分子特征,研究了非人灵长类下丘脑对OB和DB的分子变化,揭示了不同下丘脑区域、细胞类型及其亚群对代谢紊乱的分子响应。这些发现有助于从单细胞和空间环路层面深入了解代谢性疾病的机制,最终有助于确定潜在的新药治疗靶点。
华大生命科学研究院雷莹研究员、复旦大学生命科学学院博士生梁宪、中国科学院大学博士生孙雨浓、西安交通大学姚婷副教授、内蒙古大学博士生宫红玉为共同第一作者。复旦大学生命科学学院刘铁民教授、张智副研究员、华大生命科学研究院刘石平研究员、徐讯研究员以及复旦大学生命科学学院孔星星教授为论文共同通讯作者。
该项目严格遵照伦理规范开展,实验所用食蟹猴由从化市华珍动物养殖场购买,不涉及中国人类遗传资源。