脑血管系统对于维持脑的机能非常重要,科学家们可以通过脑血管研究神经退化的机制,以及药物向中枢神经系统递送的过程,但脑血管的细胞和分子特征研究仍存在很多空白。因此,定义脑血管细胞亚群对科学家深入理解脑血管很有帮助。2022年,剑桥大学的Myriam Heiman等研究人员利用snRNA-seq单细胞测序技术解析了人脑血管各类细胞的表达特征。
研究人员鉴定了11种血管细胞亚型,包括3种内皮细胞亚型、5种包括周细胞和平滑肌细胞在内的壁细胞亚型,以及3种血管周围成纤维细胞亚型。研究人员发现了人沿动静脉轴上的特异性表达模式,并确定了以前未被记录的细胞类型特异性标记,包括 ARL15、TSHZ2、GRM8 和 TRPM3。此外,研究人员利用这些人类特异性特征研究了亨廷顿病患者的3,945个脑血管细胞的表达差异,这些变化揭示了血管和神经胶质细胞类型中先天免疫信号如IKBKB、IRF2/3的激活,以及维持血脑屏障完整性所必需的蛋白质水平的降低。
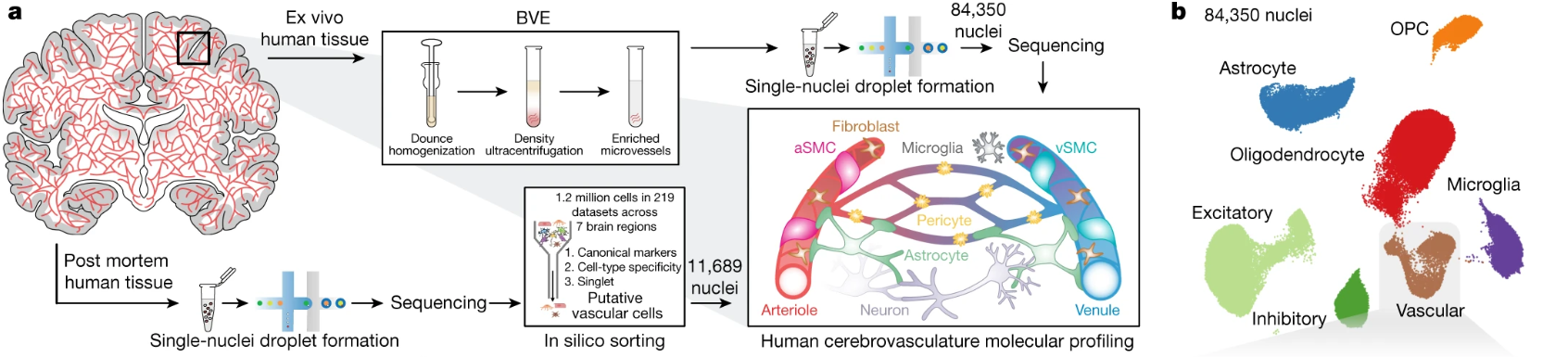
单细胞转录组鉴定人脑血管细胞类型[2]
空间转录组学技术与单细胞RNA测序技术相比,拥有了空间位置坐标的信息,为转录组数据提供了更多维度的分析和解读空间。在脑科学研究中,不同脑区以及他们的亚层结构往往具有特异性的表达模式,而空间转录组技术能帮助科学家们了解细胞亚群在空间分布上的特征,有助于刻画脑区细微结构的范围和边界,对全面理解大脑结构有新的认知。
同时,通过解析细胞在空间上的表达规律,研究人员得以知道邻近区域细胞间可能存在的互作情况,从而还原脑内微环境的分子活动。通过探索疾病状态下的细胞空间表达模式以精准定位疾病在发展和治疗过程中活跃的区域,为治疗靶点的寻找提供重要线索。空间转录组学技术的应用,在传统的影像学技术之外,为研究人员提供了一个全新的视角去了解脑的细微结构,是探索脑疾病机制的有效工具。
华大自主研发的时空组学技术Stereo-seq具备大视场、500 nm超高分辨率的优势,能够在组织、细胞、亚细胞、分子水平开展空间分析,展现全景的空间转录表达模式,帮助研究人员揭示大脑各神经亚群在空间上的表达特征和动态变化,进一步推动脑科学研究发展。
经典案例二 ▶ 蝾螈端脑再生过程中的重要神经干细胞亚型鉴定
包括人类在内的哺乳动物大脑,由于其再生能力有限,损伤后修复极具挑战性。硬骨鱼、蝾螈等低等脊椎动物表现出了强大的器官再生能力,且蝾螈的大脑解剖结构与哺乳动物有一定的相似性,因此它是研究大脑再生的理想模型,对进一步了解哺乳动物大脑再生的内在局限性,以及未来中枢神经系统再生医学的发展至关重要。2022年,杭州华大生命科学研究院、深圳华大生命科学研究院联合广东省医学科学院、华南师范大学、武汉大学等多家科研单位,利用华大自主研发的时空组学技术Stereo-seq绘制了首个蝾螈端脑发育及再生的时空单细胞转录组图谱,鉴定了蝾螈端脑再生过程中的重要神经干细胞亚型(reactive ependymoglial cell, reaEGC),并比较了其状态与发育时期神经干细胞的相似性。该成果在2022年9月2日以背靠背封面文章的形式发表于国际顶级学术期刊Science。
研究人员实现了单细胞分辨率的成年蝾螈端脑脑区的分布和细胞类型的绘制,鉴定了成年蝾螈端脑有wntEGC、sfrpEGC、ribEGC三种EGC亚型,且ribEGC维持高度增殖状态,并鉴定了与发育相关的EGC亚型dEGC。他们通过分析再生的空间转录组数据,发现蝾螈端脑损伤早期出现且与再生密切相关的神经干细胞亚型reaEGC。通过脑损伤的拟时序分析,发现神经元再生过程中的细胞谱系空间动态变化规律,即reaEGC作为祖细胞分化成IPCs,再分化为未成熟的神经元、成熟神经元。
该研究首次绘制了蝾螈端脑损伤再生和发育单细胞分辨率的时空转录组图谱,探究创伤修复、组织再生及细胞分化机制,并发现与损伤再生密切相关的细胞类型reaEGC,深化了对机体组织器官自我修复与原位再生的认识,对人类神经系统损伤修复或退行性疾病的治疗及再生医学应用具有关键性的指导促进意义。
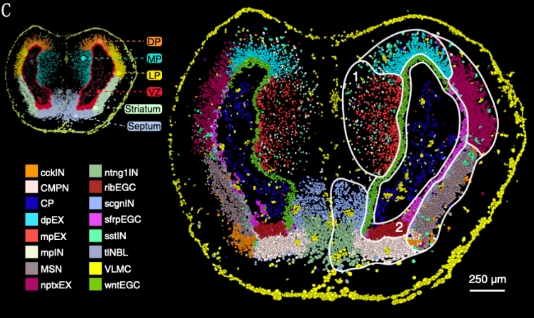
蝾螈端脑各细胞类型的空间分布[3]
单细胞+时空组学 | 了解脑的精细结构并挖掘脑疾病潜在治疗靶点
随着单细胞RNA测序和空间转录组技术在脑科学研究领域应用的兴起,两种测序技术的联合分析方案逐渐成为热门的多组学联合手段。基于单细胞转录组可精确展现细胞亚群异质性和空间转录组的空间信息等优势,科学家可以通过空间映射、解卷积或将空间转录组数据通过细胞分割等算法得到细胞水平的转录表达信息,并与单细胞的细胞亚群信息进行匹配,从而精确表现细胞亚群在空间上的分布情况和微环境动态,得到高精度、大视野的脑细胞图谱。单细胞和空间转录组联合的多组学分析不仅能深入了解脑的细胞结构,更能为疾病的药物治疗提供更细致的分子和位置靶点。
经典案例三 ▶ 成年猕猴全脑皮层单细胞分辨率空间图谱揭示细胞组织模式
灵长类的大脑结构和细胞组成与人类大脑高度相似,因此构建灵长类大脑空间表达图谱对洞悉人脑的空间表达模式有重要的参考意义。2023年,中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)与华大生命科学研究院等单位合作,利用华大自主研发的高分辨率时空组学技术Stereo-seq和snRNA-seq构建了全球首个非人灵长类全脑皮层空间单细胞图谱,为未来大脑在进化、发育、衰老和发病机制过程中的细胞和分子研究提供了重要的数据资源。
研究团队在谷氨酸能和GABAergic神经元内发现大量由转录组定义的细胞类型。此外,该研究构建了单细胞解析的细胞类型3D皮质图谱,发现了各脑区的细胞组成是以功能脑叶差异的模式被分割聚集在一起的特点。该研究通过分析皮质脑区间的细胞差异,揭示了几个与皮质脑区层级结构相关的细胞组织规律。一是,三种主要细胞类别都包含其脑区密度与感觉系统的皮质层级呈显著线性相关的细胞亚型;二是,这些感觉系统间共享许多与层级结构呈显著线性相关的细胞类型;三是,与层级结构负相关的谷氨酸能细胞亚型的数量远高于GABAergic细胞亚型;四是,非神经细胞类型的区域分布仅与层级结构水平呈正相关。这些组织规律可能是随着层级结构信息处理复杂性不断增加的细胞基础,该研究结果为进一步研究不同细胞类型在不同层级皮质区域中的具体作用提供了良好基础。
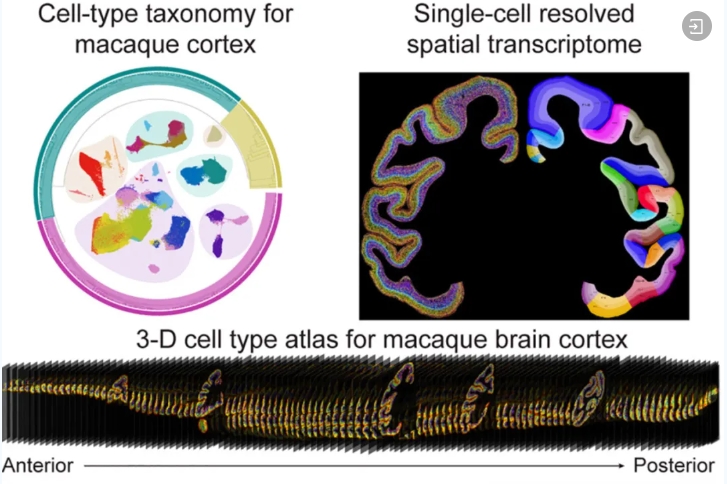
猕猴脑的单细胞和3D皮质图谱[4]
收集不同年龄的样本进行单细胞和时空组学联合分析,有助于科学家展示出人脑发育的动态过程和分子表达演变。2023年,中国科学院动物研究所研究员焦建伟等研究人员利用华大自主研发的时空组学技术Stereo-seq结合scRNA-seq,首次解析了迄今为止跨时间点最广(6孕周-23孕周,GW6-GW23)、面积最大(最大4 cm × 3 cm)的人脑多区域时空发育转录组图谱。
研究人员首先鉴定出了神经前体细胞、谷氨酸能神经元、GABA能神经元、少突胶质细胞前体细胞、星形胶质细胞前体细胞神经外胚层来源的主要细胞类型,以及中胚层来源的细胞类型(如内皮细胞,周皮细胞和小胶质细胞)等。根据细胞注释结果,他们进一步将神经前体细胞(NPC)分为五个亚群,包括RG、IPC、GCP、Prec1和Prec2,观察到RG最先出现,并有独特的空间分布特点。同时,他们将谷氨酸能神经元和 GABA能神经元分别进一步分为17个和20个亚群,发现亚型存在显著的背腹侧分布差异。此外,他们将OPC和APC分为五种和六种亚型,发现存在显著的空间分布偏好,如在GW16时,Dien腹侧中OPC和APC亚型的比例都高于Dien背侧。
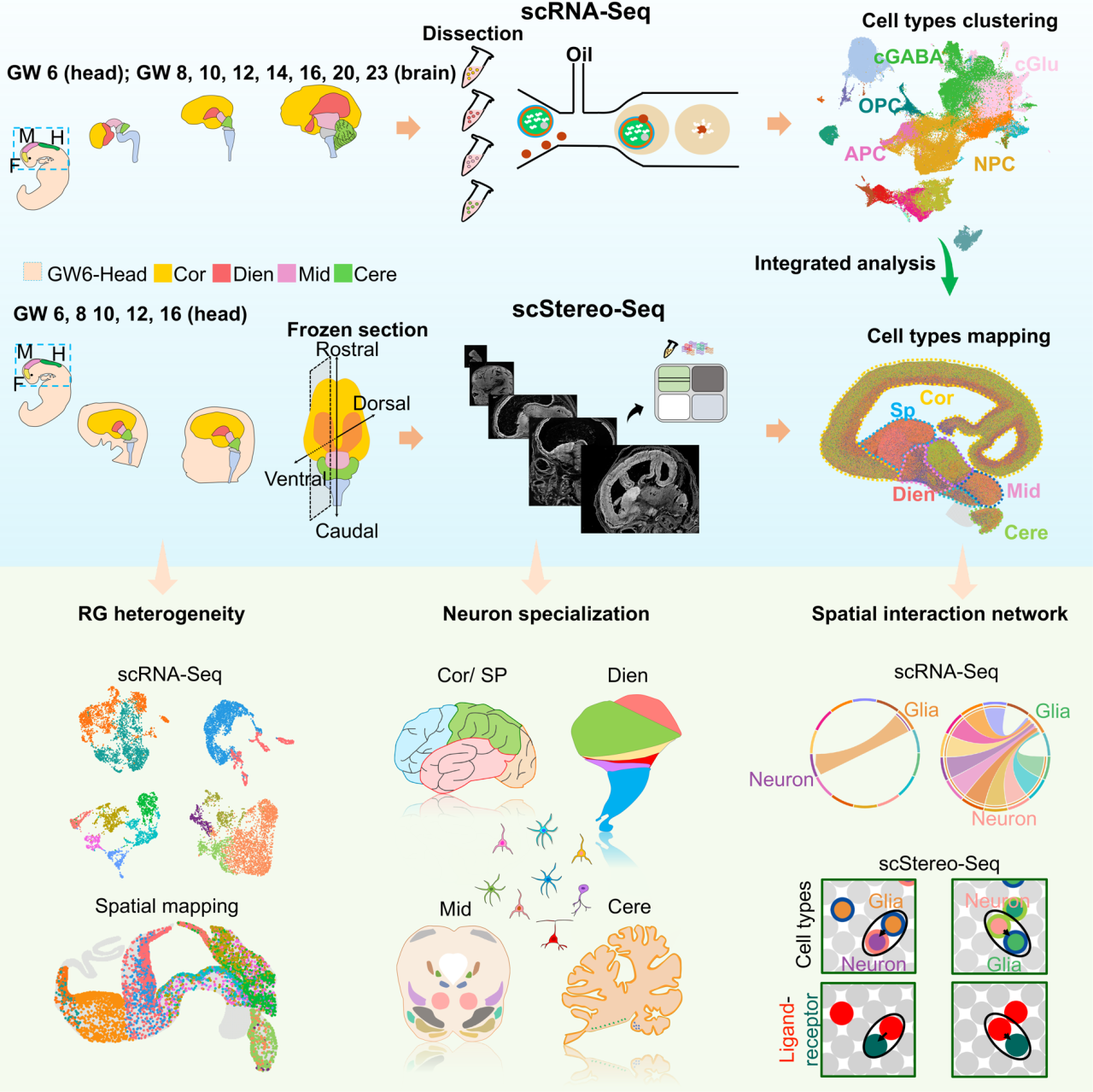
构建人胎脑的单细胞和空间图谱[5]
华大时空组学技术Stereo-seq是研究高分辨率空间多组学数据的前沿技术。针对大尺寸样本个性化需求,华大时空开发了时空转录组大尺寸芯片解决方案,该方案现已推出芯片尺寸为1 cm × 2 cm、2 cm × 2 cm、2 cm × 3 cm的标准试剂盒产品,开创了对整个组织切片进行全转录组研究的先河。此外,该方案支持个性化定制,捕获面积最大可达6 cm × 6 cm,为您的科学研究提供更多选择。
大尺寸芯片单次实验检测面积更大,大大降低了空间转录组实验对样本尺寸的限制,精准匹配目标组织器官大小,助力研究人员在发育生物学、神经科学、肿瘤疾病等研究领域解析完整的细胞空间表达模式,可真正实现器官和生命全景分子细胞图谱的绘制。

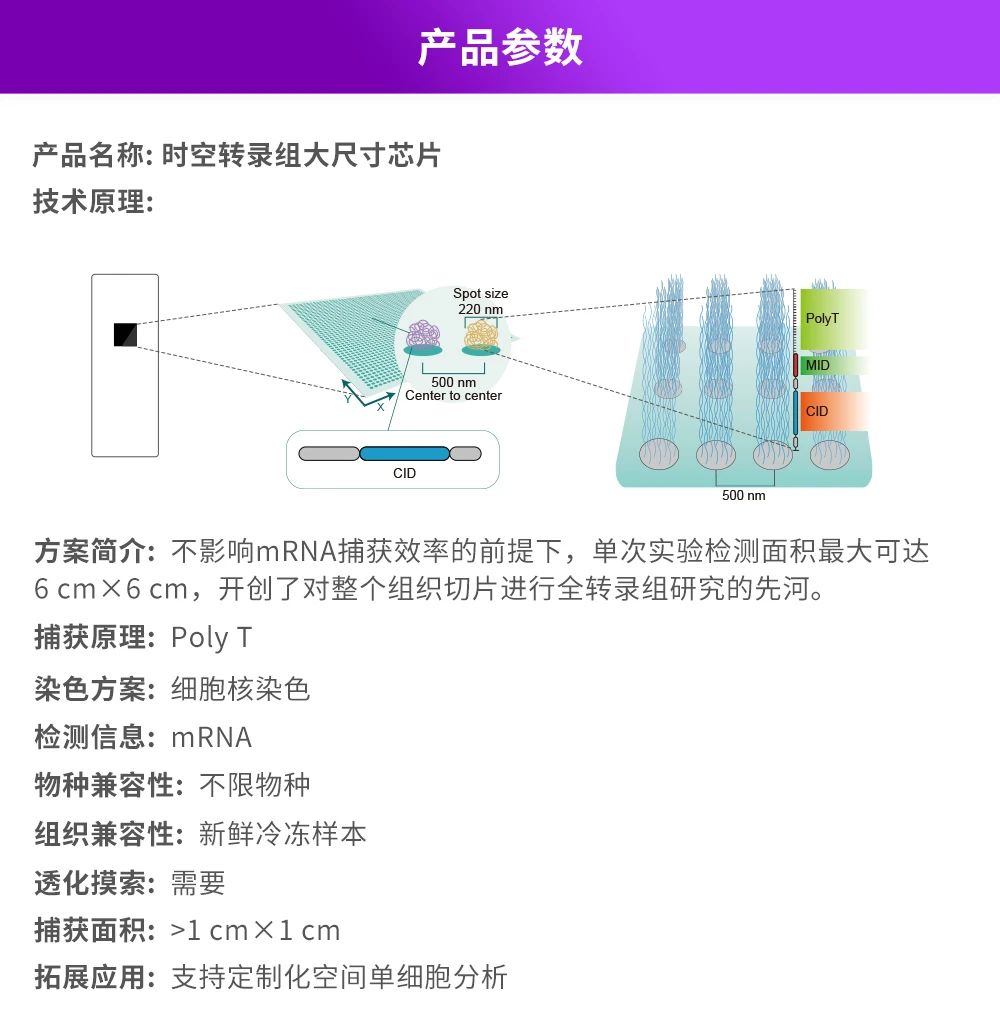
时空转录组大尺寸芯片产品方案详情请在时空官网查看:
https://www.stomics.tech/products/stereo-seq-transcriptomics-large-chip-design
1. Steinmetz J D, Seeher K M, Schiess N, et al. Global, regional, and national burden of disorders affecting the nervous system, 1990–2021: a systematic analysis for the Global Burden of Disease Study 2021[J]. The Lancet Neurology, 2024, 23(4): 344-381.
2. Garcia F J, Sun N, Lee H, et al. Single-cell dissection of the human brain vasculature[J]. Nature, 2022, 603(7903): 893-899.
3. Wei X, Fu S, Li H, et al. Single-cell Stereo-seq reveals induced progenitor cells involved in axolotl brain regeneration[J]. Science, 2022, 377(6610): eabp9444.
4. Chen A, Sun Y, Lei Y, et al. Single-cell spatial transcriptome reveals cell-type organization in the macaque cortex[J]. Cell, 2023, 186(17): 3726-3743. e24.
5. Li Y, Li Z, Wang C, et al. Spatiotemporal transcriptome atlas reveals the regional specification of the developing human brain[J]. Cell, 2023, 186(26): 5892-5909. e22.
内容 | 朱宁远
审核 | 赵芳、张嘉琦、黎晓玲、廖上峰