近日,杭州华大生命科学研究院联合吉林大学、中国科学院分子细胞科学卓越创新中心、广州医科大学第五附属医院、山西医科大学等机构,利用华大自主研发的高分辨的时空组学技术Stereo-seq,以及高通量单细胞转录组测序技术DNBelab C4,绘制了小鼠肝脏稳态-2/3切除-再生模型的时空转录图谱。该研究在全肝叶尺度解析了稳态与再生状态下肝实质细胞和非实质细胞的分子梯度,精确定义了基因网络如何通过细胞间通信动态调控以促进再生。
研究还确定了转录共激活因子Tbl1xr1作为一个连接炎症与能量代谢的桥梁诱导肝细胞增殖。该研究为正确理解肝脏稳态和再生提供了丰富的数据资源,也为未来进一步探究哺乳动物肝脏生理和功能障碍奠定了重要基础。
该研究2024年4月16日发表于Nature Genetics,以下是文章的详细解读。

文章题目:A spatiotemporal atlas of mouse liver homeostasis and regeneration
发表时间:2024-04-16
发表期刊:Nature Genetics
主要研究团队:杭州华大生命科学研究院、吉林大学、中国科学院分子细胞科学卓越创新中心、广州医科大学第五附属医院、山西医科大学等
影响因子:30.800
DOI:0.1038/s41588-024-01709-7
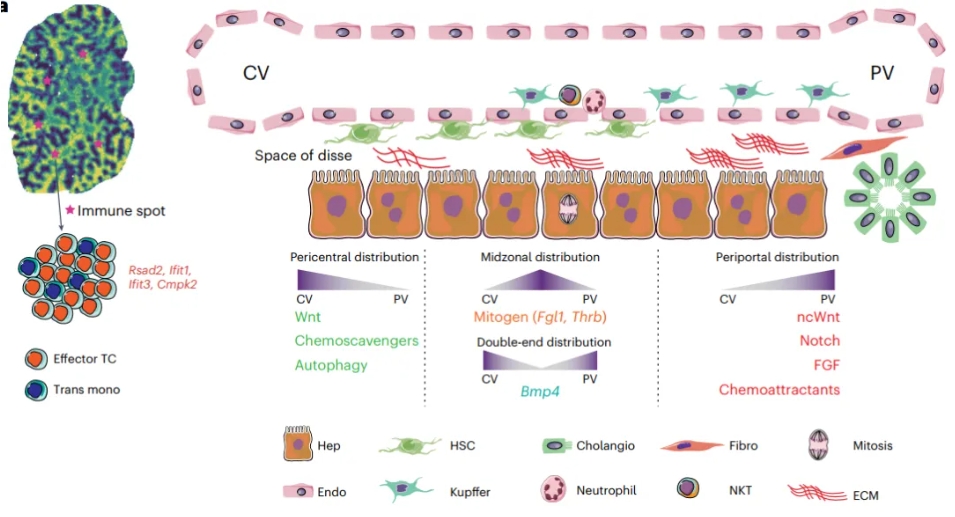
研究肝脏稳态选定的分子事件示意图
肝脏是人体的主要代谢器官,负责处理营养物质和有毒物质。哺乳动物的肝脏由重复的肝小叶单元组成。在微观结构上,肝小叶是由肝中央静脉(CV)为中心和围绕其周围的若干个门静脉(PV)三联管(门静脉,动脉,胆管)区域为顶点组成,形成了以同心区或环组织的多边形结构,穿过门静脉-中心静脉轴的血液流经其中,形成了物质浓度和多种信号的梯度分布,并形成了肝实质细胞的空间分工和微环境非实质细胞的空间分布,这一现象又称为区带化(zonation),由所有细胞类型沿门-中心轴紧密组织和交织的分工组成。
肝脏还有一个特征是肝细胞具有显著的重建损伤肝脏的功能,肝再生是一个高度协调的过程,依赖于细胞间通讯,以惊人的保真度将肝脏质量恢复到损伤前的水平。理解控制肝脏分区和增殖的机制为研究再生医学以及阐明许多疾病的路线图提供了线索。单细胞组学和空间解析的转录组学技术为肝脏分区和再生提供了相关见解。
应用PHx小鼠模型,收集第0天(D0)、启动期(8 h)、增殖期(D1、D2、D3)和终止期(D7、d4)的全肝叶组织30份。进行Stereo-seq以及相应样本的scRNA-seq。
1. Stereo-seq结合scRNA-seq数据构建肝脏稳态的时空转录图谱
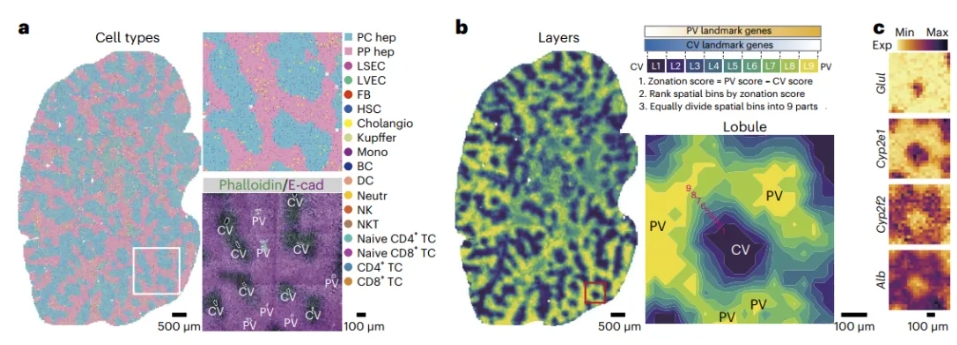
该研究基于一组标志性基因,计算了门静脉-中央静脉的转录组梯度,从而构建了连续的肝小叶网络。在此基础上,研究者寻找了稳态肝脏中肝实质细胞、内皮细胞、肝星状细胞区带化分布的基因(图1),寻找到了一系列过去未被定义的具有区带化分布特征的基因,如找到了中间区带表达水平更高的甲状腺激素受体Thrb,在CV、PV两端表达水平更高的肝细胞增殖抑制因子Bmp4,这可能与稳态中间区肝细胞自我更新能力强有关;也识别了细胞自噬相关基因在CV区高度富集,并且通过免疫荧光验证了自噬标志物LC3也在这一区域高表达;同时发现递呈、招募趋化因子的非典型趋化因子受体Ackr1在PV区域富集,而降解趋化因子的受体Ackr2/4在CV区域富集,这可能参与肝脏免疫区带化的形成。
除此之外该研究还首次发现了肝脏中存在约50~200 μm大小的解剖微结构“immune spot”,对其进行定位并解析了其中的免疫细胞类型组成,发现主要由T细胞和单核细胞组成(图2)。研究人员推测其可能是肝脏免疫响应的特殊机制,可协助肝脏抵御外源细菌或抗原。这一研究发现丰富了对肝脏免疫微环境的认识。
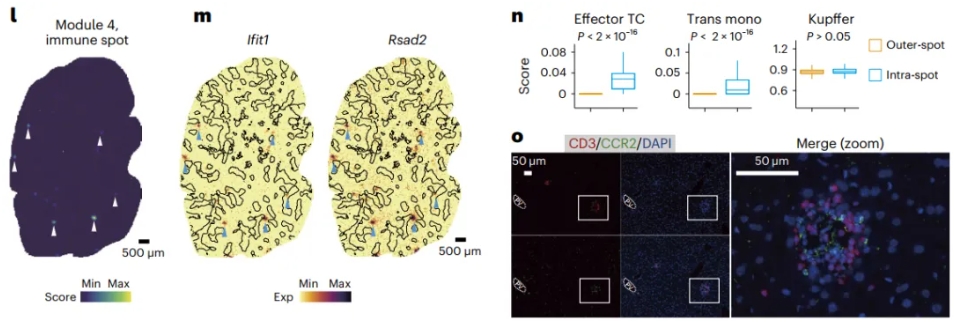
图2 免疫微结构基因的空间可视化及标记细胞类型在免疫点内外的分布
2. Stereo-seq和scRNA-seq联合分析解析70%切除肝脏再生过程的时空调控网络
2/3部分肝切除是研究肝脏再生的经典模型,本研究联合空间转录组和单细胞转录组分析,解析了小鼠肝部分(2/3)切除后,细胞增殖的时空动态变化特征,同时阐明了肝再生过程中代谢及细胞间调控网路是如何在空间上协调正确的再生发生。研究发现肝切除诱导的再生过程中肝脏仍然保持着分区特征,但所有分区的代谢功能均下调;肝细胞增殖起始于中间区域,并向PV和CV区域延伸;再生过程中不同分区细胞的应答存在差异,如CV区域有更高的Wnt和NF-κB通路激活,PV区域有更高的IL6通路激活,中间区域有更高的核糖体生成;再生过程中immune spot和免疫区带化存在丢失、重建(图3)。
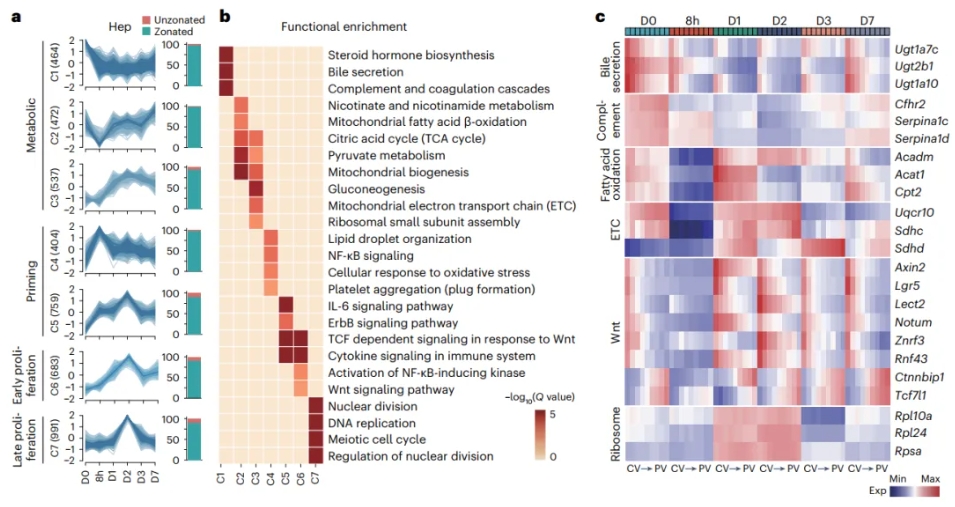
图3 Stereo-seq分析肝再生不同阶段的高变基因解析再生肝脏的时空响应
3. 空间分辨率的基因调控网络揭示TBL1XR1是肝脏再生的关键调控因子
通过空间基因调控网络分析,该研究鉴定了一系列可能参与肝脏分区维持的重要转录因子,同时阐明基因调控网络是如何在时间和空间上协调肝脏再生。其中发现了促进NCoR/SMRT转录抑制复合体降解的辅因子TBL1XR1在肝切除8小时后被强烈激活。基因调控网络分析发现Tbl1xr1可能受炎症信号调控,且TNFa中和抗体处理可抑制肝切后Tbl1xr1的激活。
为了进一步探索Tbl1xr1在肝再生过程中的功能,研究者利用AAV8介导肝细胞特异性敲降Tbl1xr1,发现敲降Tbl1xr1后显著降低了肝切除后肝细胞增殖水平,证明Tbl1xr1在肝再生过程中发挥了重要调控作用。通过bulk RNA分析发现敲降Tbl1xr1后,Wnt信号通路和脂肪酸氧化通路被显著抑制,这可能是Tbl1xr1影响肝再生的机制。
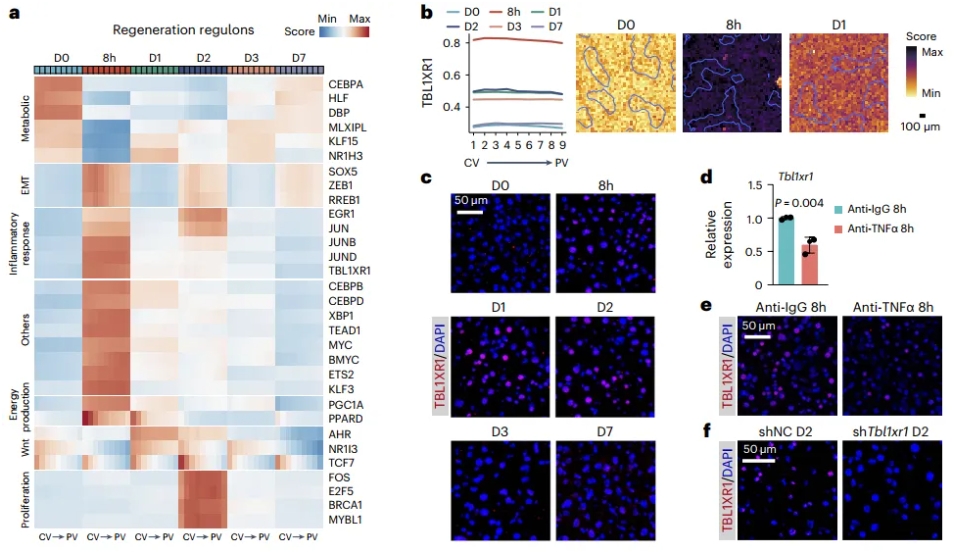
图4 再生肝脏中每个分层区的调控活性及TBL1XR1调控因子的空间可视化
该研究以前所未有的空间分辨率揭示了稳态肝脏不同细胞类型基因表达、微环境信号交流的分区特征。此外强调了2/3肝切除诱导的肝再生过程中,肝脏分区特征一直保持,但所有分区的代谢功能都存在部分丢失;同时解析了微环境信号交流以及基因调控网络在肝再生过程中的时空变化特征;最后验证了炎症诱导的Tbl1xr1是肝再生过程中重要调控因子。这项研究为正确理解肝脏稳态、肝再生提供了丰富的数据资源,创建了时空转录图谱交互式数据库(网站:https://db.cngb.org/stomics/lista/),为未来的肝脏生理学和功能障碍图谱构建奠定了基础。
许江山、郭鹏程、郝世杰、上官顺成、石泉和Giacomo Volpe为论文共同第一作者,Miguel A. Esteban、赖毅维、陈奥、刘龙奇、徐讯、郭鹏程为该研究的共同通讯作者。该项研究得到了国家自然科学基金(集成项目)、科技部等项目资助,以及深圳国家基因库的帮助与支持。所有相关数据可通过在线交互式数据库查询和下载(LISTA: https://db.cngb.org/stomics/lista/)。






