近日,中国科学院分子细胞科学卓越创新中心惠利健研究组联合杭州华大生命科学研究院,利用华大自主研发的高分辨的时空组学技术Stereo-seq,以细胞水平的空间分辨率构建了小鼠胆汁淤积损伤与再生的时空转录组图谱,揭示了该过程中的损伤响应和微环境信号的时空动态变化特征。
研究发现了胆管细胞在胆汁淤积损伤下作为信号枢纽,与PV区域免疫细胞重塑、肝细胞重编程高度相关。同时,该研究还发现Atoh8作为胆汁淤积下限制肝细胞增殖的重要因子。这项研究为解析胆汁淤积下的细胞动态和分子机制提供了新的视角,为胆管相关疾病的治疗提供了可能的新靶点。
该研究2024年4月16日发表于Nature Genetics,以下是文章的详细解读。

文章题目:A spatiotemporal atlas of cholestatic injury and repair in mice
发表时间:2024-04-16
发表期刊:Nature Genetics
主要研究团队:中国科学院分子细胞科学卓越创新中心、杭州华大生命科学研究院等
影响因子:30.800
DOI:10.1038/s41588-024-01687-w
肝小叶是哺乳动物肝脏的基本结构和功能单位,由于肝小叶内不同代谢分区肝细胞异质性的存在,人类肝病的发生发展往往显示出空间异质性。例如,对乙酰氨基酚和非酒精性肝病大多始于中央静脉(CV)附近;而胆汁淤积性疾病胆汁淤积是由于胆汁分泌及排泄障碍引起的,倾向于在胆管周围的门静脉(PV)发生。具体来说,大多数胆汁淤积疾病导致PV区域的胆管反应、炎症和纤维化,严重时还伴随着肝细胞再生的障碍,可能导致胆囊炎、肝硬化、肝衰竭等系列疾病的发生。
此前研究发现,胆汁性淤积损伤后,胆管细胞大量增殖,可能影响门静脉区的损伤,但具体细节尚待探究。门静脉区肝细胞会重编程为肝祖样细胞(LPLC),在肝脏再生过程中发挥作用。随着损伤撤去后,肝脏修复起始,肝细胞大量增殖,这一现象主要发生在中央静脉区,但控制这种增殖的机制尚不明确。
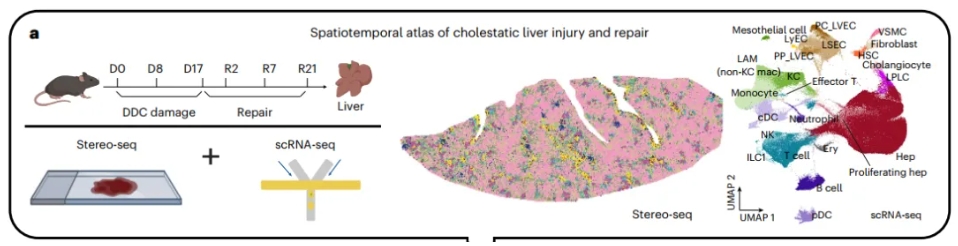
应用C57BL/6小鼠模型,在6个时间点收集了DDC损伤和损伤撤去时的肝脏,包括正常肝脏(DDC损伤前第0天,D0), DDC损伤第8天和第17天的肝脏(D8和D17),恢复第2、7和21天的肝脏(R2、R7和R21)进行Stereo-seq和scRNA-seq。
1. Stereo-seq结合scRNA-seq构建DDC诱导的胆汁淤积损伤及修复的时空图谱
该研究针对小鼠DDC饮食损伤模型进行探索。DDC饮食是一种模拟人类胆汁淤积的小鼠模型,通过诱导胆小管堵塞来引发PV区损伤。研究人员根据所有时间点的一组标志性基因进行分层,这些基因具有区带表达模式(图1)。在损伤最严重的阶段(D17),胆管细胞、血管平滑肌细胞(VSMCs)、门静脉周围肝血管内皮细胞(PP_LVECs)、淋巴内皮细胞(LyECs)、成纤维细胞和髓系细胞显示出PV富集的分布。通过整合Stereo-seq和scRNA-seq,高分辨的空间组学成功地捕捉到了肝脏内最具代表性的区域性事件Zonation以及区域性的细胞分布。
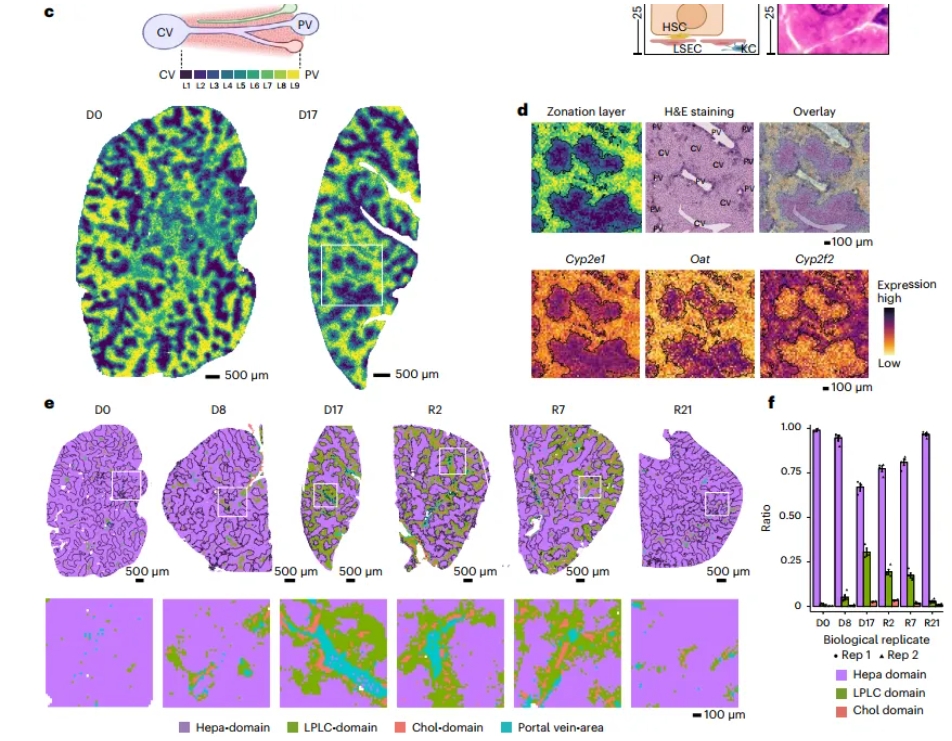
图1 Stereo-seq解析了区域性组织损伤的时空动态性
该研究利用Stereo-seq数据在时间水平和空间水平分析了受损肝脏的共享差异表达基因(DEGs)。研究发现,参与核糖体、炎症反应和细胞外基质(ECM)重塑的通路在损伤后的胆管结构域和LPLC结构域中上调(图2)。氧化应激在D8增加并呈现广泛分布,损伤相关分子模式(DAMP)、衰老、炎症和纤维化在D17的胆管结构域和LPLC结构域上调。损伤反应主要发生于固有免疫细胞,而非淋巴细胞(图2)。
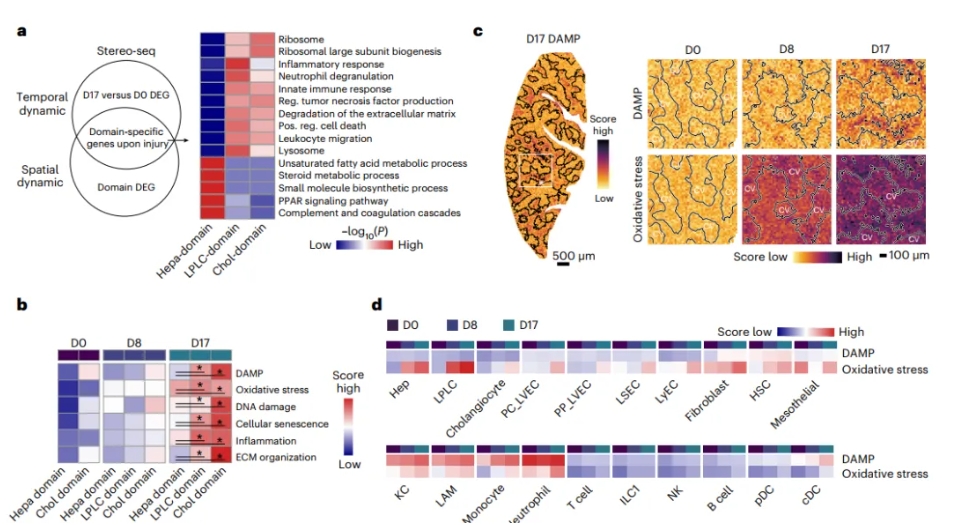
图2 Stereo-seq解析了组织损伤的时空动态性
3. 胆管细胞驱动的信号主导了PV区域的细胞间相互作用
通过深入分析胆汁淤积损伤下PV区域的空间互作,研究人员发现胆管在不同细胞间的配体和受体数量最多,且配对功能种类也最多。再加上胆管是胆汁淤积损伤的主要响应成分,胆管可能作为信号枢纽,整合PV区环境中的细胞互作。胆管除了高表达一些趋化因子外,还表达Csf1,可以直接使monocyte分化成巨噬细胞。空间上原位信息显示损伤下胆管周围有monocyte和LAM(脂质相关的巨噬细胞)的聚集。谱系示踪标记monocyte证实大部分LAM由monocyte转变而来,这些数据进一步支持胆管分泌的Csf1与monocyte到LAM的分化相关(图3)。
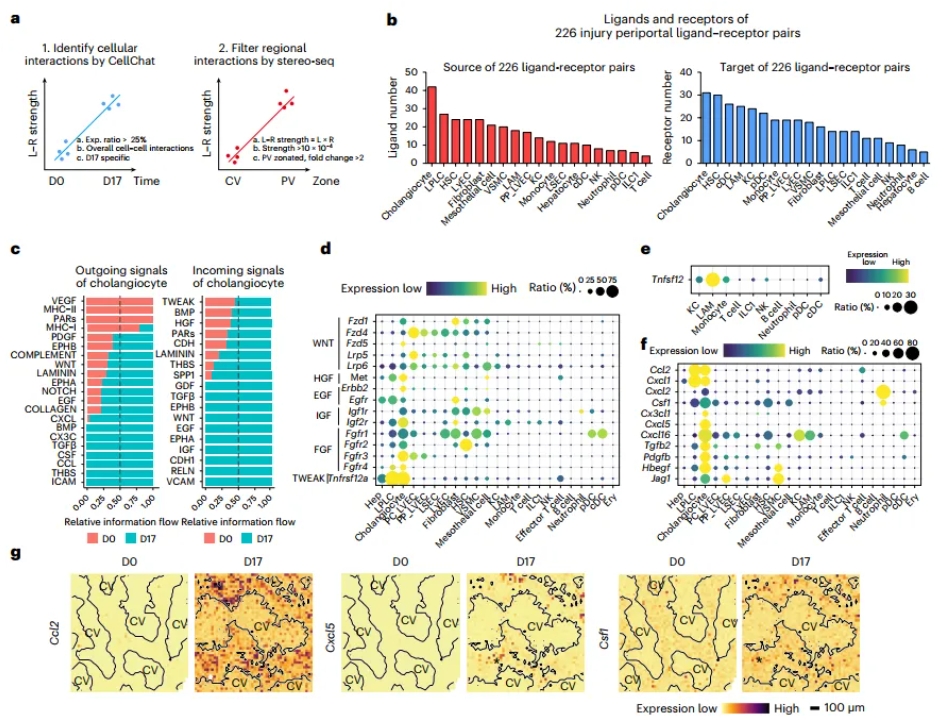
图3 胆管细胞驱动的信号在协调PV区损伤响应中具有类似枢纽的功能
研究还发现,损伤下肝细胞的重编程过程中,LPLC可以分为两群,其中LPLC_2处在向胆管分化的更晚期的轨迹上,且在空间与基因表达上更接近于胆管区域。这暗示LPLC亚型可能由所处的不同微环境来塑造。LPLC区域2富集了较强的Tgfβ信号,胆管及其区域中也较强地分泌Tgfb2,这提示胆管hub通过分泌转化生长因子Tgfβ,可能与周围的LPLC2向胆管属性转变有关(图4)。
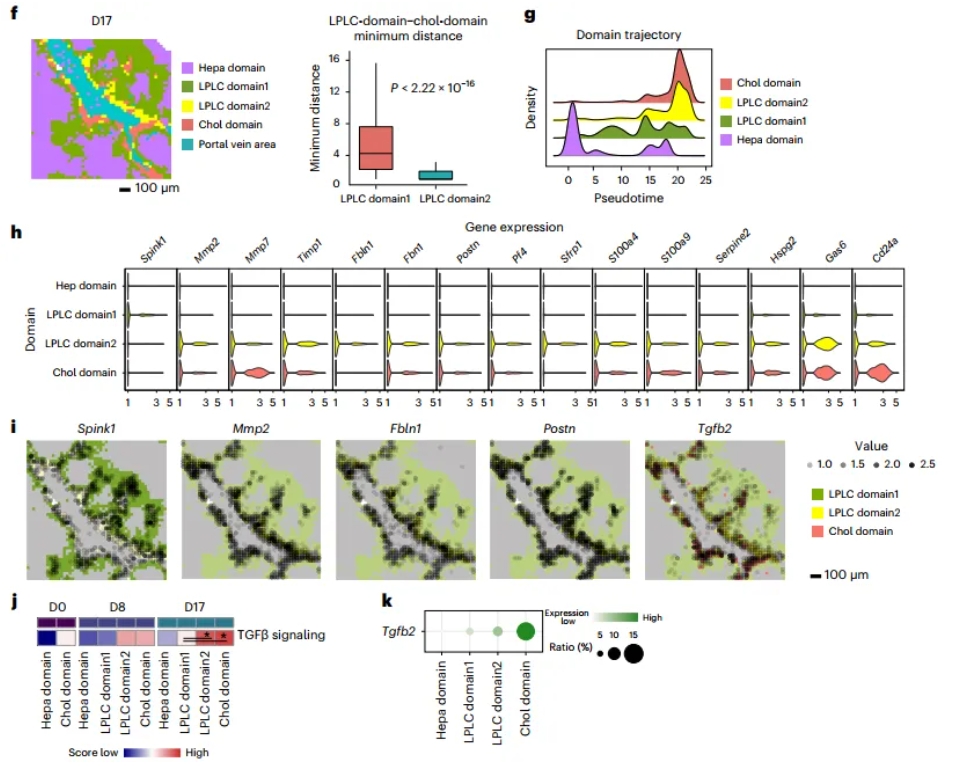
图4 确定LPLCs的空间异质性
研究人员对损伤撤去后的分子事件进行了解析,利用Stereo-seq探索修复过程中肝细胞增殖的区域动态变化。在DDC损伤撤去后的2天,空间组中捕捉到了强烈的增殖信号,并沿肝小叶逐渐下降。有趣的是,在损伤的第十七天,CV和PV区域都出现了许多再生信号,如CV区的WNT,PV区的EGF、IGF等,然而肝细胞并没有明显的增殖。通过转录因子调控网络分析,研究人员发现Atoh8可能是一个限制了肝细胞再生的潜在因子。为了验证这一假设,研究人员用AAV在肝细胞中特异性敲低了Atoh8,结果显示,敲降Atoh8组的肝细胞在损伤下出现了明显的增殖现象,从而加速了肝脏再生(图5)。
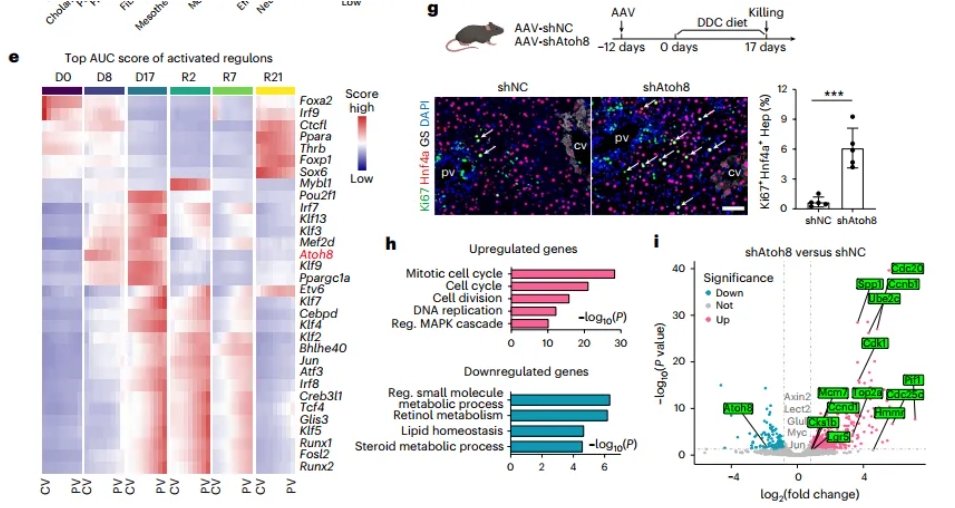
图5 肝脏再生过程中的再生调节因子与转录调控网络的时空动态性
该研究以前所未有的分辨率构建了胆汁淤积损伤与再生的时空转录组图谱。研究强调了胆管介导的信号在整个过程中的核心作用,它不仅是被动损伤,还积极地参与到PV区脂质相关巨噬细胞(LAM)的成熟和LPLC的重编程过程中。此外,该研究还发现Atoh8作为肝细胞增殖的调节因子,调控胆汁淤积由损伤向修复的转换。该研究不仅为深入理解区域性肝损伤提供了丰富的数据资源和新的视角,也为促进胆汁淤积下的肝细胞再生提供了潜在的干预策略。
吴柏华、申屠忻怡、南海涛、郭鹏程和郝世杰为论文共同第一作者,惠利健、Miguel A. Esteban、刘龙奇和赖毅维为该研究的共同通讯作者。该项研究得到了国家自然科学基金(集成项目)、科技部、上海市科委等的项目资助,以及深圳国家基因库的帮助与支持。所有相关数据可通过在线交互式数据库查询和下载(CIRSTA: https://db.cngb.org/stomics/cirsta/)







