深圳华大生命科学研究院主导,联合国内外多个单位,利用华大自主时空组学技术Stereo-seq,解析了在小鼠胚胎发育过程中的转录组表达的时空动态变化。该小鼠胚胎发育图谱将有助于深入探究哺乳动物发育的机制。该成果于2022年5月4日发表于Cell,以下是文章共同第一作者吴亮博士的详细解读。

文章题目:Spatiotemporal transcriptomic atlas of mouse organogenesis using DNA nanoball-patterned arrays
发表时间:2022年5月4日
发表期刊:Cell
主要研究团队:深圳华大生命科学研究院、中国科学院广州生物医药与健康研究院、MIT(麻省理工学院)等
影响因子:41.582
DOI:10.1016/j.cell.2022.04.003
理解一个全能性干细胞受精卵是如何随着时间和空间的变化,以精确的调控发育形成一个复杂的生物体,一直是最令人着迷的科学挑战之一。近年来,单细胞组学测序技术的发展,研究人员对小鼠胚胎发育过程的动态的基因表达和调控有了非常详尽的描述。但由于技术限制,研究人员并不能准确地对发育过程中细胞的位置和功能进行探索。因此,发展高精度的空间转录组技术,将是进一步解析哺乳动物发育中复杂性的关键。
目前,已有多种可以高通量地获得组织中转录组原位表达信息的方法,但是这些方法在单细胞分辨率上存在明显的劣势,且捕获区域有限,仅能应用于小鼠早期的胚胎或一些发育中后期特定的组织,如大脑皮层,无法应用发育中后期的小鼠胚胎中,这为研究器官形成带来了巨大的挑战。
本研究基于DNA纳米球阵列芯片和原位mRNA捕获技术,建立了具有迄今最大捕获面积(最大174.24cm2)、最灵敏的基因捕获(1,450个UMI/100μm2)和单细胞分辨率(500 nm)的Stereo-seq技术,并应用该技术解析了小鼠胚胎发育中晚期器官发生的基因空间表达模式,绘制了器官发育的轨迹图,构建了小鼠器官发育时空转录组图谱。
来自12周的C57BL/6J雌性小鼠的嗅球和大脑;发育至第9.5天(E9.5)至第16.5天(E16.5)共8个时间点的小鼠胚胎。
研究策略
结合DNA 纳米球阵列芯片以及原位mRNA捕获技术,建立了具有高分辨率和大视场的时空转录组测序技术Stereo-seq。并利用Stereo-seq技术,构建了从E9.5到E16.5共8个时间点的小鼠胚胎器官发育时空转录组图谱。
研究结果
1. Stereo-seq的技术参数优于当前其他空间转录组技术
用于mRNA原位捕获的Stereo-seq芯片(Stereo chip),使用了与华大DNBSEQ测序技术相同的芯片加工工艺,具有规则排列的活性点(Spot),每个Spot点的直径约为220nm,两个Spot点的中心点的距离为500nm。Stereo chip的制备过程和Stereo-seq技术原理如下:首先利用一段随机合成的25nt序列作为空间坐标(coordinate identity,CID),包含25nt随机合成序列,经过滚环扩增复制,形成DNA纳米球(DNA nanoball,DNB)。DNB随后被结合到Stereo chip上,并落入芯片中数十亿规则排列的Spot上。通过DNBSEQ测序仪对芯片上的DNB进行测序(第一轮测序),获取25nt的CID序列及对应的空间坐标。然后通过生化合成将CID序列与UMI分子和捕获探针(Oligo-dT)连接,构建成完整的捕获芯片(图1A,步骤1到步骤3)。随后,将10µm厚度的冷冻包埋组织切片贴敷在Stereo-seq捕获芯片的表面,经过组织固定和透化,释放组织中的mRNA,并被Stereo chip原位捕获。被捕获的mRNA经过逆转录合成带有CID序列的cDNA,再进行扩增、文库构建和高通量测序(第二轮测序),测序数据分析中可通过CID序列还原mRNA分子在Stereo chip中的物理位置,进而对应获得高分辨率的组织原位表达信息(图 1A,步骤4到步骤6)。
相较于目前已报道的空间转录组学测序技术,Stereo-seq具有最高的分辨率(500nm),同时具有最大的捕获面积(此研究中使用的最大的芯片为200mm2,完整的可用于原位捕获的Stereo chip最大面积做到174.24cm2;图1B)。而且,在相同的精度下,Stereo-seq具有更强和更灵敏的mRNA捕获能力(图1C)。
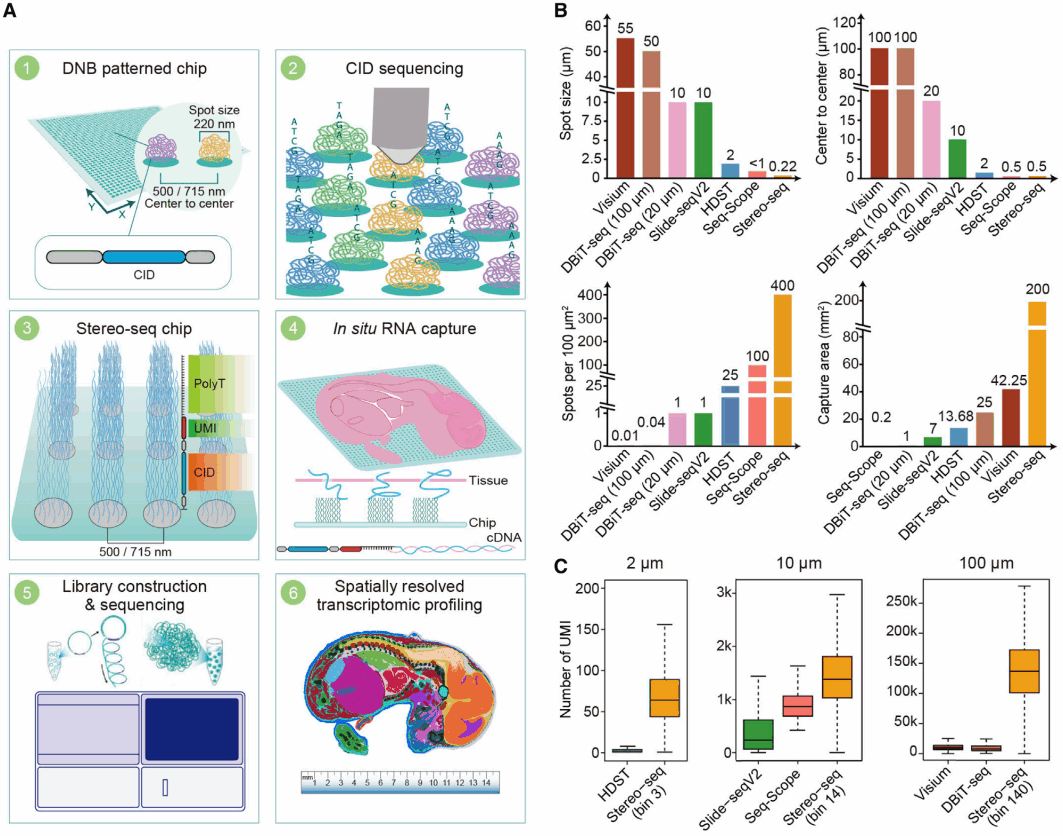
图1 Stereo-seq原理示意图和分辨率、灵敏度以及视场性能比较
2. Stereo-seq能够在组织层面和单细胞层面解析基因表达空间异质性
为了进一步评估Stereo-seq对组织中细胞构成的空间异质性的解析能力,研究人员将Stereo-seq应用于成年小鼠的大脑半脑冠状切面的空间表达图谱分析研究。在组织进行透化前,利用核酸染料进行染色记录,并与Stereo-seq产出的空间转录组位置信息进行对比(图2A),显示两者的空间位置信息高度重叠,表明Stereo-seq实现了准确的原位捕获。随后,基于核酸染色的细胞定位,对Stereo-seq转录数据进行了单细胞分割分析(cell segmentation)(图2A、图2B),鉴定到27个细胞类群/亚类,包括来自不同区域的8类兴奋神经元亚类(excitatory neuron,EX)、4类表达不同神经化学因子的抑制性神经元亚类(inhibitory neuron,IN)和5类具有不同区域分布的放射状胶质细胞亚类(astrocyte,Astr)(图2C、图2D)等。
同时,研究人员也评估了Stereo-seq对组织功能区域鉴定的能力。对bin50(50×50DNB bins,25µm)的数据,利用自主开发的非监督的SCC(spatially-constrained clustering)聚类方法,进行聚类分析,鉴定到共20个大脑功能区,包括大脑皮层的不同分层,海马、丘脑、纹状体等结构及其亚结构(图2C)。
综上,Stereo-seq既可以基于影像进行细胞分割,获取单细胞水平的空间组转录组数据,也可通过binning的方式,识别组织中的不同功能区域。
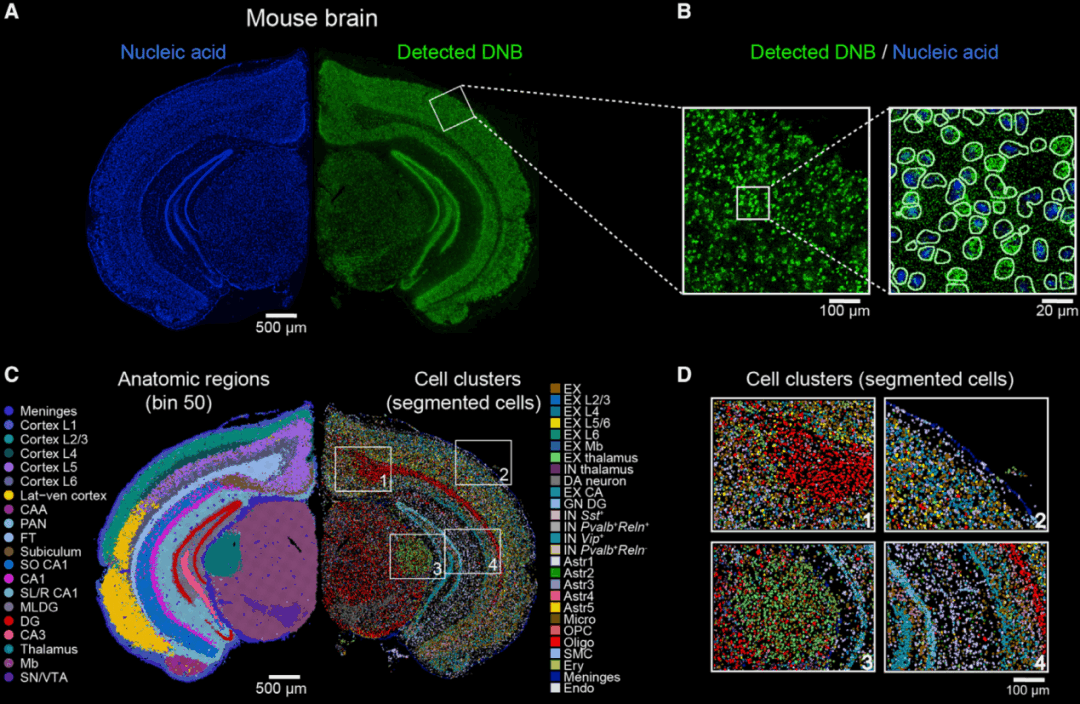
图2 Stereo-seq的单细胞分辨能力
3. 构建小鼠胚胎器官生成空间转录组图谱
研究人员利用Stereo-seq技术建立了小鼠器官发生的时空转录组图谱(mouse organogenesis spatiotemporal transcriptomic atlas, MOSTA;https://db.cngb.org/stomics/mosta/),展示了其研究应用潜力。该图谱包含了53个矢状切片,解析了小鼠胚胎发育过程中,从E9.5到E16.5间共8个时间点,全胚胎范围的转录组时空动态变化。其中13个切片来自同一个E16.5胚胎的不同切面,构建了胚胎发育接近终末期的三维空间转录组图谱(图3)。
通过SCC算法对每个切面的胚胎进行聚类分析,鉴定了与每个时间点相匹配的主要组织和器官,例如皮肤、骨骼、肌肉、心脏、肺等及其组织特异性的表达信息(图3)。并利用TOME(trajectories of mammalian embryogenesis)分析算法对不同时间点的胚胎的功能器官区域构建了发育轨迹图(图4)。
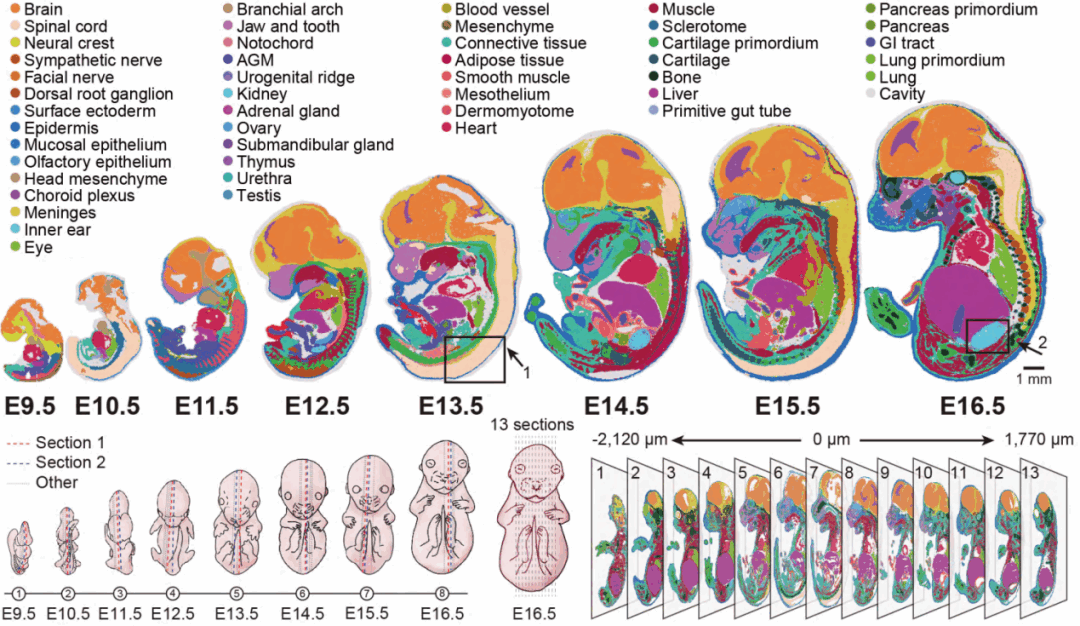
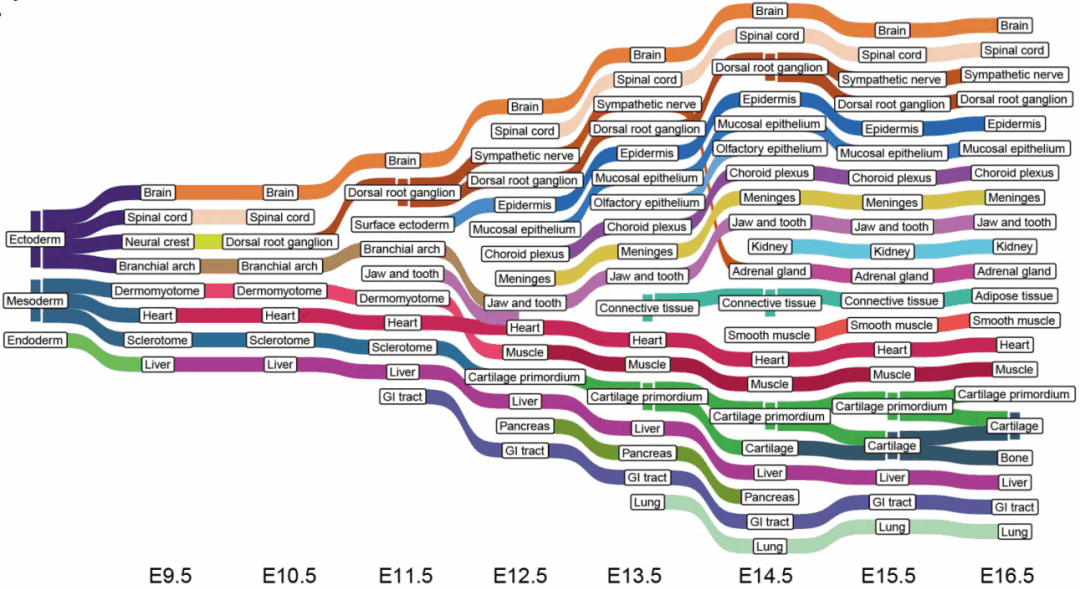
图4 小鼠器官发生发育轨迹图
4. 鉴定小鼠胚胎组织中细胞类型分布的空间异质性
在单细胞水平上,对胚胎进行空间转录组分析,对了解组织发育过程中的细胞命运的动态变化至关重要。研究人员对E16.5的小鼠胚胎,进行了基于影像的单细胞分割,将捕获率较低的细胞进行过滤之后,获得了281,377个细胞,平均每个细胞有1,107个UMI以及529个基因。对细胞进行无监督聚类并UMAP可视化后,得到了25种主要的细胞类型(图5A),包括放射状胶质细胞、上皮细胞、平滑肌细胞、内皮细胞、巨噬细胞等。
进一步对上皮细胞和成骨细胞进一步分类后,发现能够鉴定到更多的细胞亚形。上皮细胞可细分为毛囊细胞(Krt5+、Krt17+)、肺泡II型细胞(Foxp2+、Nkx2-1+)、支气管外分泌细胞(Scgb3a2+、S100a6+)、肺纤毛细胞(DynIrb2+、Foxj1+)、胸腺上皮细胞(Tcrg-C1+、Tbata+)等(图5B)。对成骨细胞的进一步分群后,发现能够鉴定到其逐渐形成和成熟过程,包括圆形成骨细胞(Sox5+、Sox9+)、柱状成骨细胞(Sulf1+、Robo1+)、前肥大成骨细胞(Prrx1+、FbxI7+)、早期肥大成骨细胞(Runx2+、Ibsp+)、晚期肥大成骨细胞(Spp1+、Mmp9+),以及髓核细胞(Pax1+、Fmod+)(图5C)。
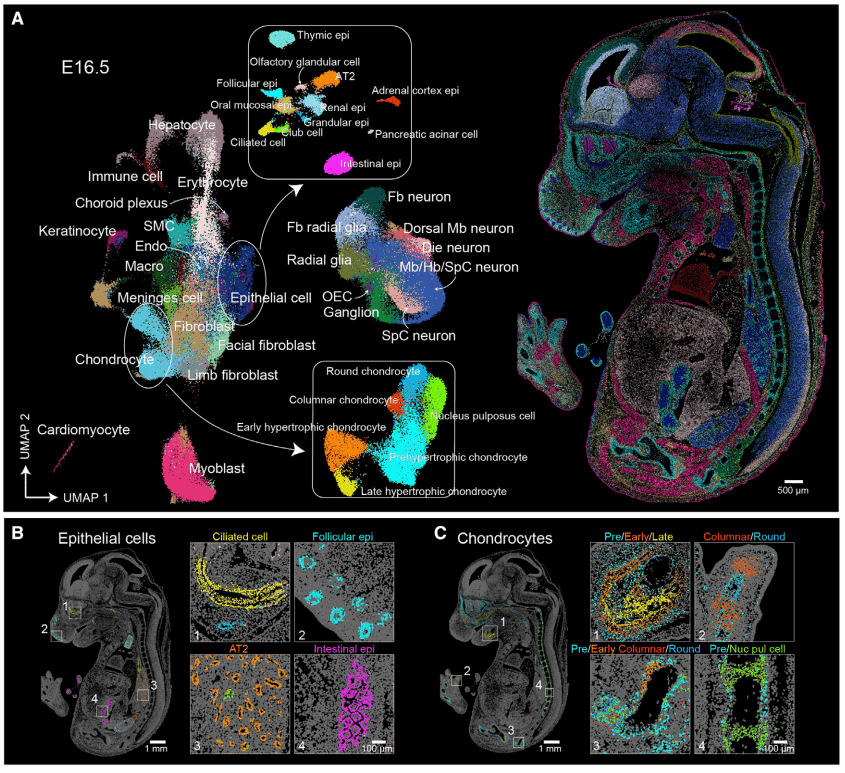
5. 背侧中脑发育过程中前体细胞的空间分布异质性
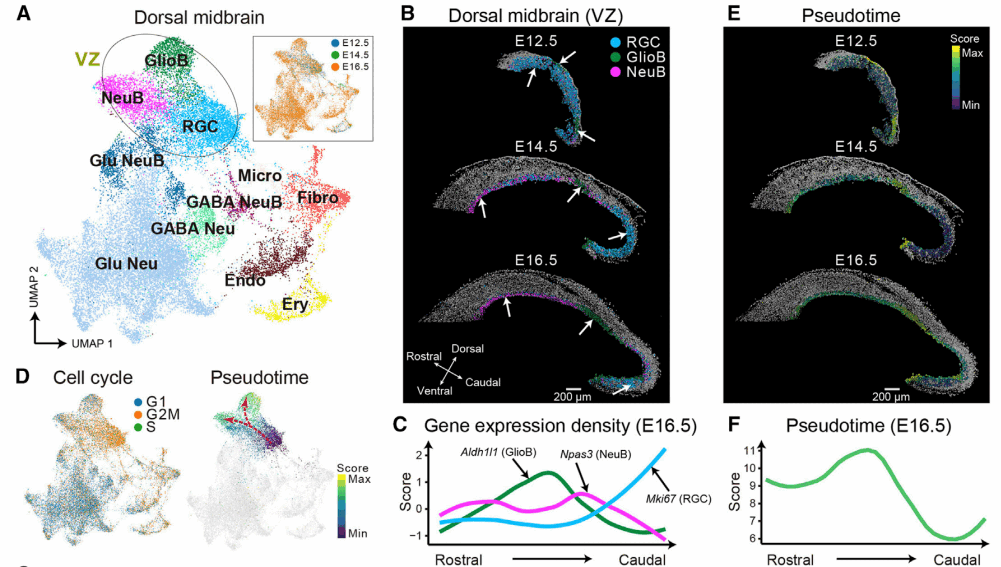
中脑具有很多非常重要的感官调控功能,如视觉、听力、运动以及温度调节等。结构上,背侧中脑还存在形成上丘和下丘的层级结构。相较于大脑的其他功能区域,发育中的中脑细胞异质性和细胞空间构成,鲜有被系统地研究。研究人员对E12.5、E14.5以及E16.5的小鼠胚胎中脑空间转录组数据进行单细胞分割、聚类,鉴定到了包括放射状胶质细胞(radial glia cells,RGC)、神经母细胞(neuroblasts,NeuB)、胶质母细胞(glioblast,GlioB)、γ-氨基丁酸能神经元 (GABAergic neuron,GABA Neu)、谷氨酸能神经元(glutamatergic neuron,Glu Neu)、小胶质细胞(microglial,Micro)等11种细胞类型(图6A)。
进一步空间映射回背侧中脑组织后,发现在不同胚胎时间点中,祖细胞(RGC)和祖细胞分化而来的NeuB,GlioB存在空间分布异质性(图6B、图6C)。在E12.5的小鼠胚胎中,RGC的含量最多,广泛分布在背侧中脑中,而这个阶段的NeuB稀疏分布在背侧中脑,而GlioB则较集中分布在背侧中脑的中段以及尾侧。在E14.5的小鼠胚胎中,背侧中脑前端的RGC已消失,只存在于脑室区的尾侧区域,NeuB和GiloB各自富集在特定的区块,表明沿着脑室区单元的组织进行程序化功能差异分化,产生了不同的细胞类型。在 E16.5中,RGC进一步减少并集中在尾端,NeuB的分布更加受限,而GlioB则在原始位置的数量增加。这些发现表明,神经发生和胶质发生不同步,RGC的分化过程具有时空不对称性。对这三个阶段的祖细胞进行空间拟时序分析(使用monocle 3),也证实了这些结果(图6D~图6F)。
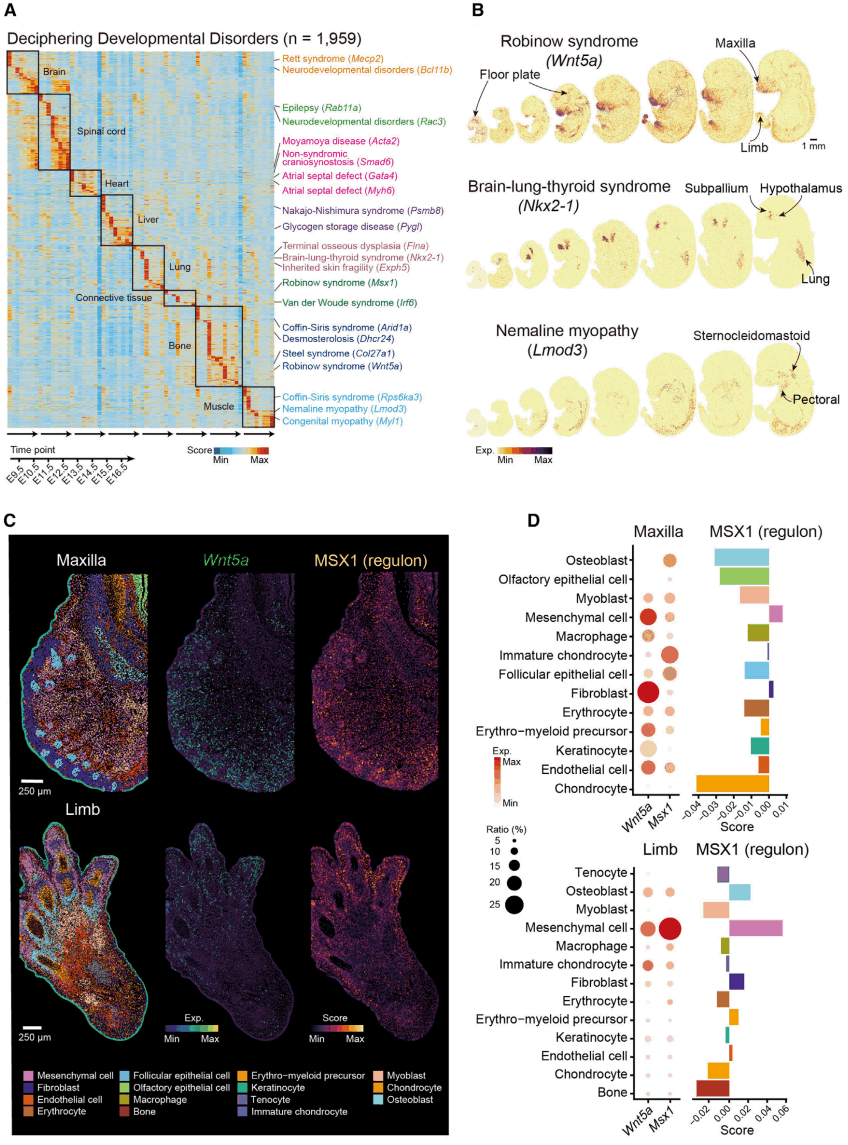
6. 系统鉴定人类发育缺陷相关基因的时空表达特征
新生儿发育缺陷产生严重的功能问题,其影响常常在发育后期显现。为探索MOSTA在解析哺乳动物遗传疾病尤其是发育缺陷相关疾病的能力和独特优势,研究人员在DDG2P(The Developmental Disorders Genotype-to-Phenotype database)数据库收集了与出生缺陷相关的基因,并分析它们在MOSTA中对8个时间点中大脑、脊髓、心脏、肝脏、肺、结缔组织、骨骼以及肌肉8个组织器官的表达情况(图6A),发现许多基因具有连锁效应,且可同时在多个器官表达。例如,导致脑-肺-甲状腺综合征的NKX2-1基因,主要在大脑中的海马体和皮层下结构以及肺中表达(图6B);导致雷宾诺综合征(Robinow Syndrome)的WNT5A表达于面部、四肢、生殖嵴和大脑中,与疾病表型相一致。
研究人员提取小鼠胚胎的上颌区域和肢体区域的数据,进一步进行单细胞分割和无监督聚类、鉴定细胞类型,发现WNT5A高表达于上颌组织中的间质细胞和成纤维细胞,而在肢体中则高表达于间质细胞中(图7C 、图7D),表明雷宾诺综合征在上颌和肢体的致病机制可能不同。进一步分析发现,WNT5A的下游调控因子MSX1在上颌骨的多种细胞类型(包括间充质细胞)中表达,但在肢体中仅限于间充质细胞中。同样,MSX1调控活性在上颌骨的间充质细胞和成纤维细胞以及肢体的间充质细胞中更高(图7C、图7D)。以上结果揭示了雷宾诺综合征疾病表型潜在分子发生机制。
总 结
空间原位表达信息是剖析胚胎发育的关键。Stereo-seq具有全转录组覆盖、单细胞分辨率、高灵敏度和大视野等特性,有利于将Stereo-seq推广应用到更多的应用场景,如研究灵长类发育、癌症等研究领域。未来,深圳华大生命科学研究院团队还将利用寡核苷酸标记的抗体同时检测细胞表面标志,或整合染色质开放组分析获得表观遗传信息。除了发展研究领域的应用,Stereo-seq也将被推广应用到更多生物医学领域,如作为补充医学成像和组织病理学数据的手段进入常规临床实践。
本研究由深圳华大生命科学研究院、中国科学院广州生物医药与健康研究院、MIT(省理工学院)等多个科研团队共同完成。陈奥、廖莎、成梦南、麻凯龙、吴亮、赖毅维和邱肖杰为该论文的共同第一作者,汪建、徐讯、刘龙奇、黎宇翔和Miguel A. Esteban为论文的共同通讯作者。本研究已通过伦理审查,严格遵循相应法规和伦理准则。
作者:吴亮








