中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)与华大生命科学研究院、临港实验室、上海脑科学与类脑研究中心、腾讯AI Lab、瑞典皇家理工学院、卡罗林斯卡医学院等单位联合,通过对成年雄性猕猴的大脑左半球进行冠状切片,结合华大自主研发的高分辨率时空组学技术Stereo-seq和snRNA-seq,绘制了全球首个非人灵长类全脑皮层空间单细胞图谱。
该研究揭示了猕猴大脑皮层各细胞类型具有脑区和层依赖的定位模式,并特别指出各种细胞类型的区域分布与视觉和体感系统中各脑区的层级结构之间的关系。跨物种比较分析进一步揭示了在L4层富集的灵长类特异性细胞类型。该文章在2023年07月12日发表于Cell,在此,我们特邀请共同一作朱志勇对文章进行详细解读。

文章题目:Single-Cell Spatial Transcriptome Reveals Cell-Type Organization in Macaque Cortex
发表时间:2023-07-12
发表期刊:Cell
主要研究团队:中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、华大生命科学研究院、临港实验室、上海脑科学与类脑研究中心、腾讯AI Lab、瑞典皇家理工学院、卡罗林斯卡医学院等
影响因子:64.500
DOI:10.1016/j.cell.2023.06.009
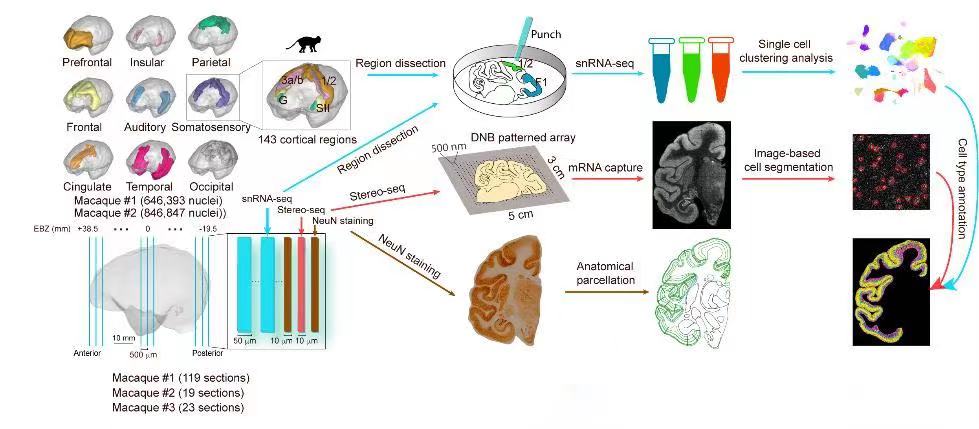
灵长类动物的大脑是最为复杂的器官,由超过60亿个细胞组成,这些细胞根据其空间、分子、形态或生理特征可分为数百种细胞类型。其中,大脑皮质是灵长类脑中最为庞大和发达的一块神经组织,与灵长类动物具有较高的认知和社交能力一致,它负责调节多种高级功能,包括感觉、语言和行为等。这些高级功能的实现需要依赖于不同细胞类型形成的特定神经环路,这些细胞和环路的异常也导致了多种脑疾病。因此,系统解析大脑皮层中各种细胞类型的组成和空间分布,对于阐明灵长类动物大脑的组织模式至关重要,同时也为深入了解脑科学的复杂机制提供了珍贵资源。大视野时空组学技术Stereo-seq提供了厘米级组织切片测序的解决方案,使研究团队能够在全脑水平上以前所未有的分辨率绘制基因表达的立体空间分布图,从而研究皮质细胞的潜在多样性和空间组织模式,以促进人们对灵长类大脑的深入了解。
大脑左半球组织采集自三只雄性食蟹猕猴(Macaca fasicularis;#1,6岁,4.2 kg;#2,4岁,3.7 kg;#3,7岁,10.6 kg)。
研究人员利用Stereo-seq和snRNA-seq对猕猴大脑左半球的皮质组织进行冠状冷冻切片测序,并对转录组进行生物信息学分析。在snRNA-seq转录谱上鉴别出不同的细胞类型,研究基于半监督DNN模型构建了从单细胞到空间的细胞类型迁移注释分类器,将snRNA-seq上的细胞分型稳健地注释到空间组单细胞水平上。同时,研究人员通过免疫组化染色和显微扫描成像辅助识别切片组织解剖结构,从而绘制出整个大脑皮质不同脑区、不同皮层的单细胞水平3D转录组图谱。然后,研究人员通过定量分析Stereo-seq数据,来探究猕猴皮层各细胞类型的空间组织模式,并特别探索脑区细粒度与视觉和体感系统层级结构的内在联系,以了解不同皮质区域功能差异的基础和细胞组织规律。由于新皮质的扩张是灵长动物出现复杂认知的关键,因此,研究人员收集了之前研究公开的不同哺乳动物(人、鼠)的单细胞数据集并进行跨物种比较分析,以解析灵长动物新皮质扩张的进化特点。
1. 猕猴大脑皮层细胞的全面分型
研究人员首先对来自两只猕猴的单细胞转录谱进行整合、聚类分析,构建了一个三级的细胞层级分型树。一级分型包括了谷氨酸能神经元、GABAergic神经元和非神经元细胞。二级确定了一级分型的主要亚型,其中谷氨酸能神经元亚型通过其层分布偏好注释(L代表层:L2、L2/3、L2/3/4、L3/4、 L3/4/5、L4、L4/5、L4/5/6、L5/6 和 L6),GABAergic神经元亚型根据标记基因LAMP5、VIP、RELN、PVALB和SST的表达注释,非神经元细胞由标记基因注释了星形胶质细胞(astrocytes,ASCs)、少突胶质前体细胞 (oligodendrocyte precursor cells,OPCs)、少突胶质细胞(oligodendrocytes,OLG)、小胶质细胞(microglic,MG)、内皮细胞(endothelial cells,ECs)和血管软脑膜细胞(vascular leptomeningeal cells,VLMCs)。三级分型是对二级分型的细化,在整个大脑皮质143个区域上总鉴定出 264个细胞簇。这种结合了空间转录组信息的snRNA-seq分析产生了猕猴大脑皮层的全面细胞类型分类(图2)。
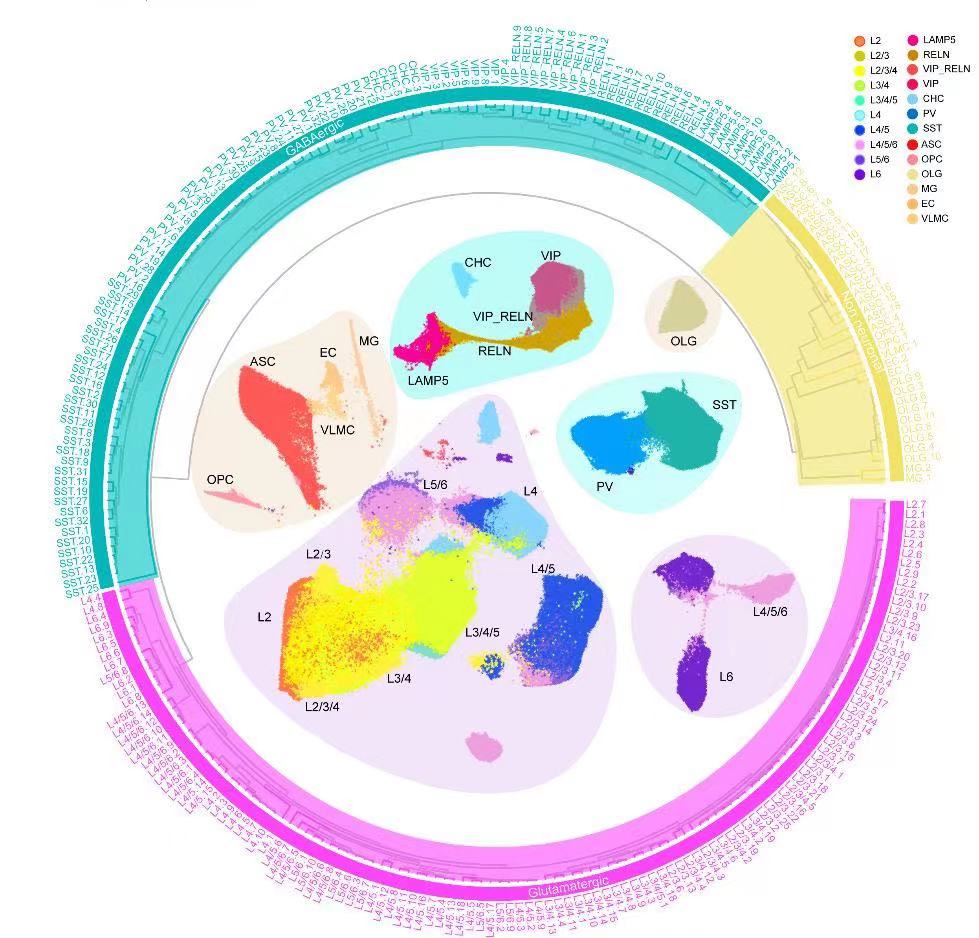
图2 猕猴大脑143个皮层区域的转录组细胞类型分类树
2. 猕猴大脑皮层不同细胞类型的空间分布
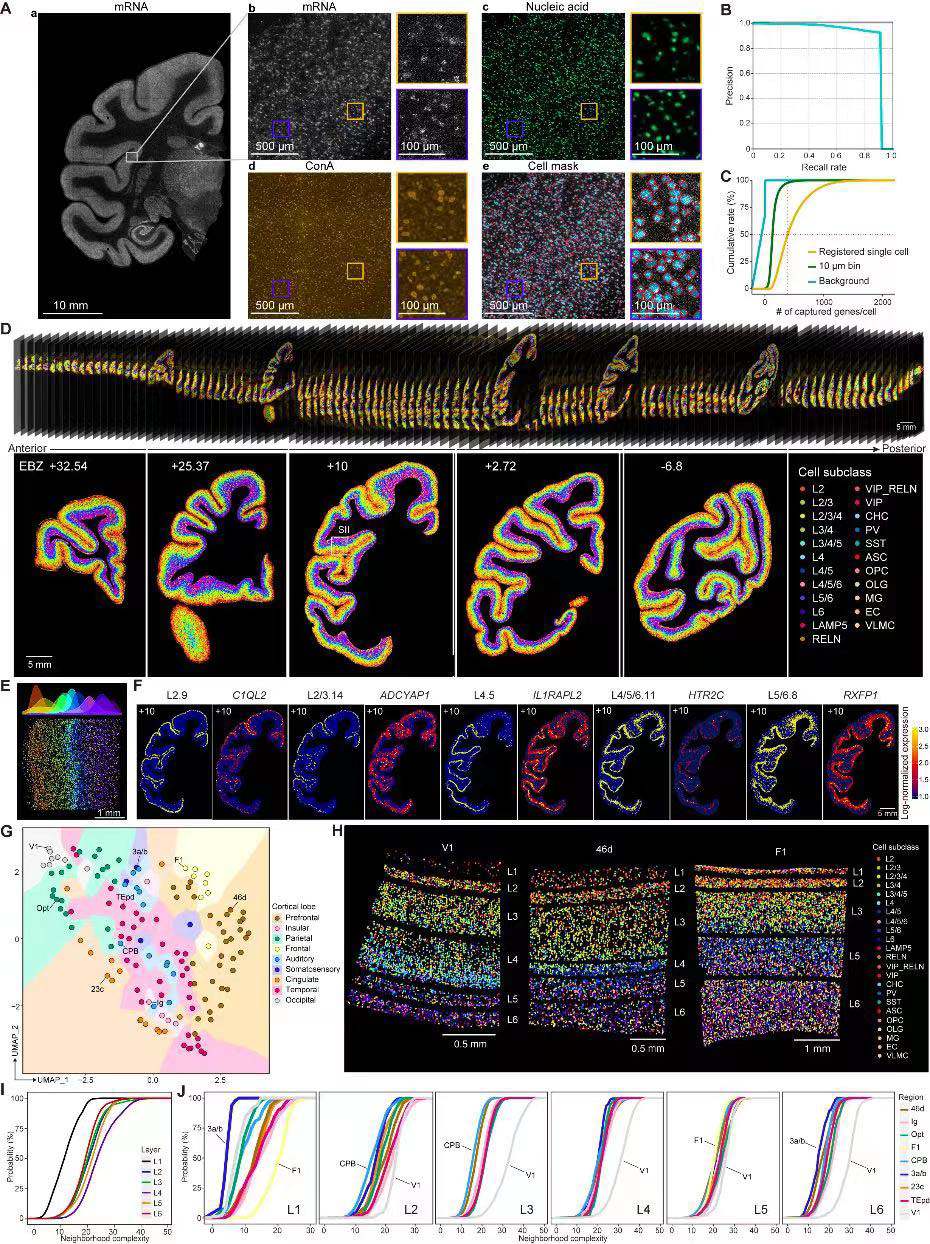
研究人员使用大型硅基芯片(最大5 cm×3 cm)对猕猴半球冠状位切取的10 µm厚度组织切片进行Stereo-seq分析,以捕获细胞的mRNA分子。每张Stereo-seq切片均用ssDNA和ConA进行染色后扫描成像(图3A),并使用自主开发的AI自动分割算法进行单细胞识别。随后,研究人员基于弱监督神经网络模型构建了从单细胞到空间细胞类型迁移注释的分类器,稳健地将snRNA-seq上鉴定的264类细胞类型注释到空间组单细胞上,为所有三只猴构建了单细胞解析的细胞类型3D皮质图谱(图3D)。
对Stereo-seq 3D图谱的定量分析,研究人员发现了各脑区的细胞组成以功能脑叶差异的模式被分割聚集在一起的特点(图3G)。由于相互靠近的细胞往往具有更高形成突触连接的可能,细胞类型在空间上的局部混合很可能表明局部神经环路的差异源于细胞组成。因此,研究人员量化分析了各个皮质层中局部细胞类型组成的“邻域复杂性”,发现细胞类型在不同的皮质层和区域上确实会表现出邻域组成的特异性,如较深皮质层的复杂性高于表层(图3H~3I),且皮质区域之间也存在着明显差异(图3J)。
3. 细胞类型组成和分布与皮质层级结构的关联
基于Stereo-seq细胞类型图谱,研究人员通过分析皮质脑区间的细胞密度差异,发现细胞密度和先前为灵长类动物视觉和体感系统定义的层级结构水平间存在显著负相关(图4A~4B),该结果支持了层级结构中较高级别脑区表现出较低细胞密度的概念。
进一步的分析显著表现出层级依赖性变化的细胞类型(图4G),研究人员发现其中部分细胞类型的分布在两个层级系统上拥有一致表现。特别有趣的是,其中许多表现出负相关且在两个系统中普遍存在的谷氨酸能神经元会优先定位于早期感觉通路(图4E-~4F)。GO分析显示,它们的标记基因与钙离子结合、跨突触信号传导和离子通道活性相关。这些结果提示了猕猴大脑中细胞组织的一般规律。
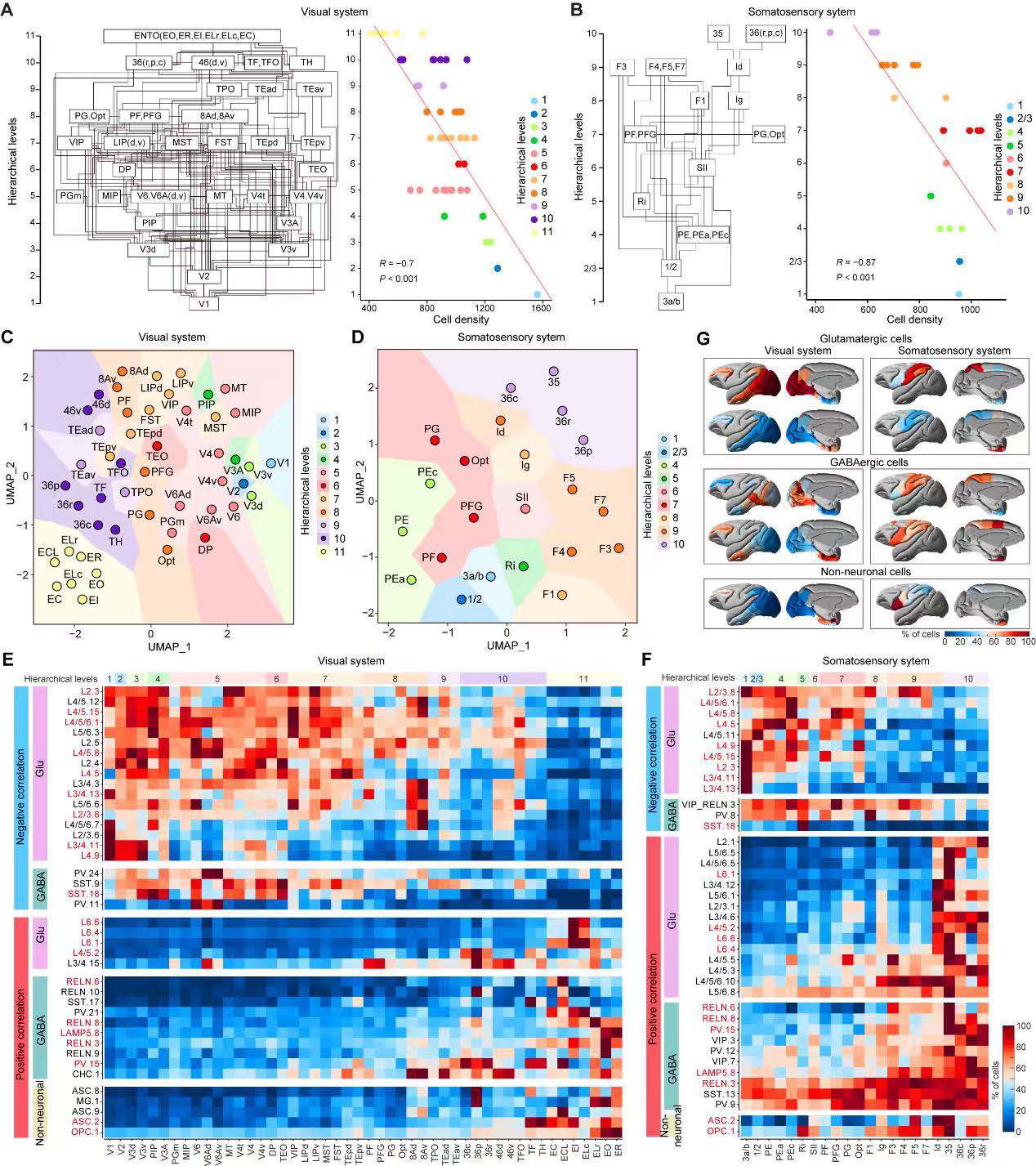
图4 细胞类型的空间分布与视觉和体感系统的解剖层级结构之间的关联
4. 谷氨酸能神经元的空间组织模式
研究人员使用Stereo-seq解析猕猴皮层组织中最大的细胞群——谷氨酸能神经元,空间定位显示这些细胞在不同脑区表现出明显的层偏好(图3D~3F、5A),这与先前在小鼠和灵长类动物中的发现一致。研究人员还进一步解析了几种高度定位于特定的皮质区域的谷氨酸能神经元,例如V1脑区特异的细胞类型具有高表达NTNG1的特点(图5G),该基因在神经元发育过程中引导轴突生长,且与精神分裂症相关。
鉴于谷氨酸能受体对于驱动皮质回路中的信息处理的关键作用,研究人员进一步分析了谷氨酸能受体基因的空间分布,并发现这些受体亚基在皮质层和脑区间具有差异表达(图5J)。这里值得注意的是,研究人员观察到GRIN2B的表达水平随着视觉和体感系统中脑区层级水平的增加而增加,与先前人类皮质层级中NMDAR-GluN2B表达增加的分析相一致(图5J)。此外,研究人员还发现许多其他谷氨酸能受体基因的表达水平与感觉系统中各脑区的层级结构水平具有正向关联。综合表明,谷氨酸能受体基因的协调表达模式可能是不同大脑区域突触功能和可塑性差异的分子基础。
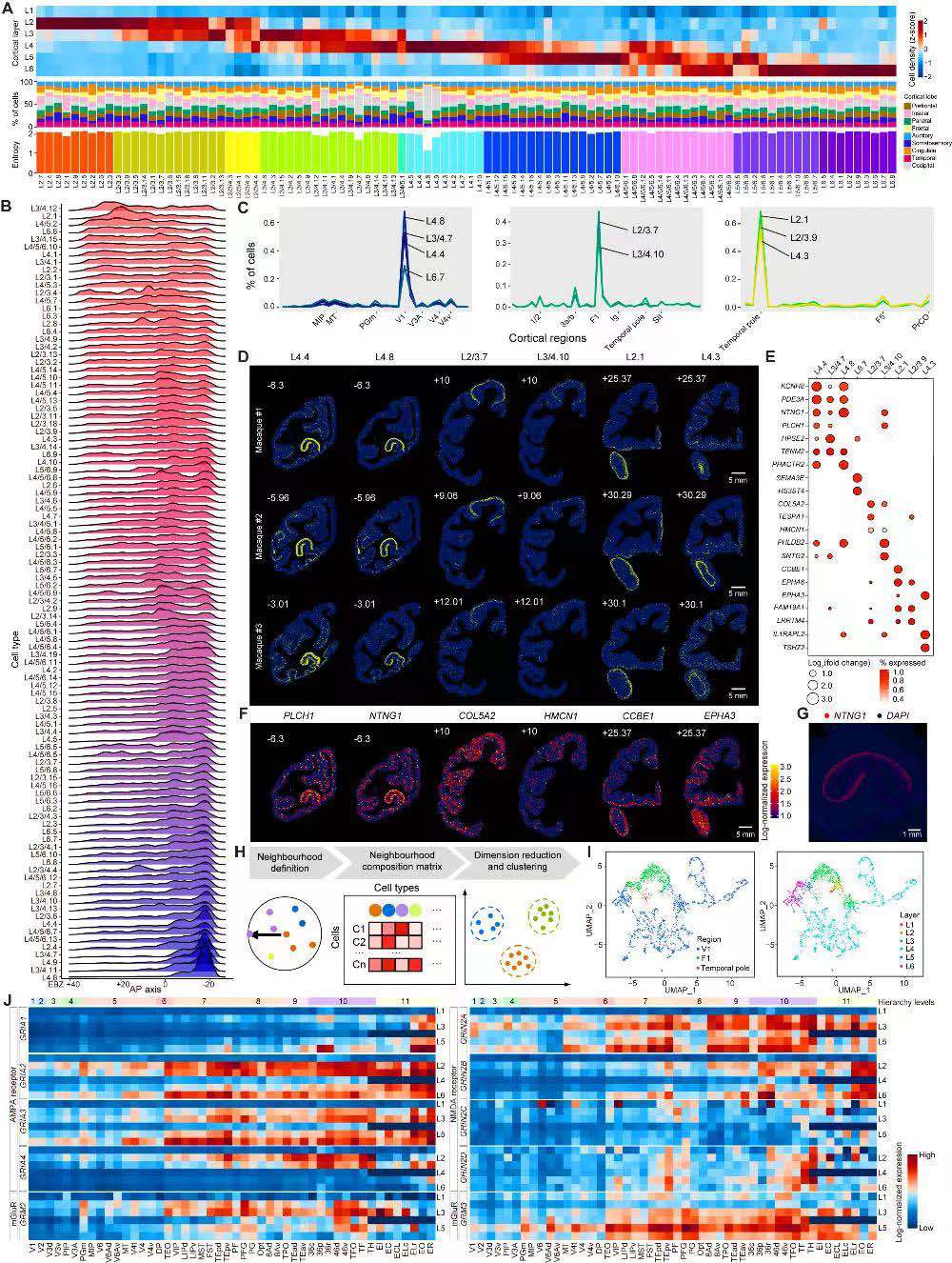
5. GABAergic神经元的空间组织模式
接下来,研究人员对GABAergic神经元空间分布进行系统解析,发现GABAergic神经元的7个亚型[RELN、LAMP5、VIP、VIP-RELN、PV、SST、CHC(chandelier subclass)]都显示跨皮质区域的层状定位特点(图6A)。细胞类型的脑区群体丰度显示,CHC在前额叶和扣带皮层中的突出分布与人类皮质中的CHC类似(图6B)。细胞类型的跨脑区密度比较分析中,研究人员发现两群沿前-后(anterior-posterior,A-P)轴表现出丰度互补的SST样神经元;无监督聚类显示,它们的组成可以简单区分9个皮质叶,对维持皮质区域功能差异可能具有潜在贡献(图6E)。
CHC神经元具有支配锥体神经元的轴突初始段,控制着神经元冲动的特性。研究人员对该类神经元作了进一步解析。CHC1、CHC2亚型在标记基因表达和空间定位、邻域组成上精细区分CHC3亚型(图6F)。综合表明,不同的CHC细胞与不同的谷氨酸能细胞形成不同的局部环路影响神经活动。
由于控制输出的PV和控制输入的SST神经元之间的比例会影响局部环路在脑区间的差异。研究人员为此特别检查了PV和SST的平衡模式,第一主成分分析显示,皮质区域内PV和SST神经的组成细粒度与感觉系统的层级结构水平高度相关(图6J),意味着具有胞体和树突靶向特性的PV和SST神经元受到严格调节,以支持各种感觉系统的功能。此外,PV/SST神经元中神经递质和神经调节受体的基因表达与两个感觉系统的层次水平之间存在显著相关性(图6K),表明PV和SST在神经网络处理的多个阶段中具有响应局部调节的特点。
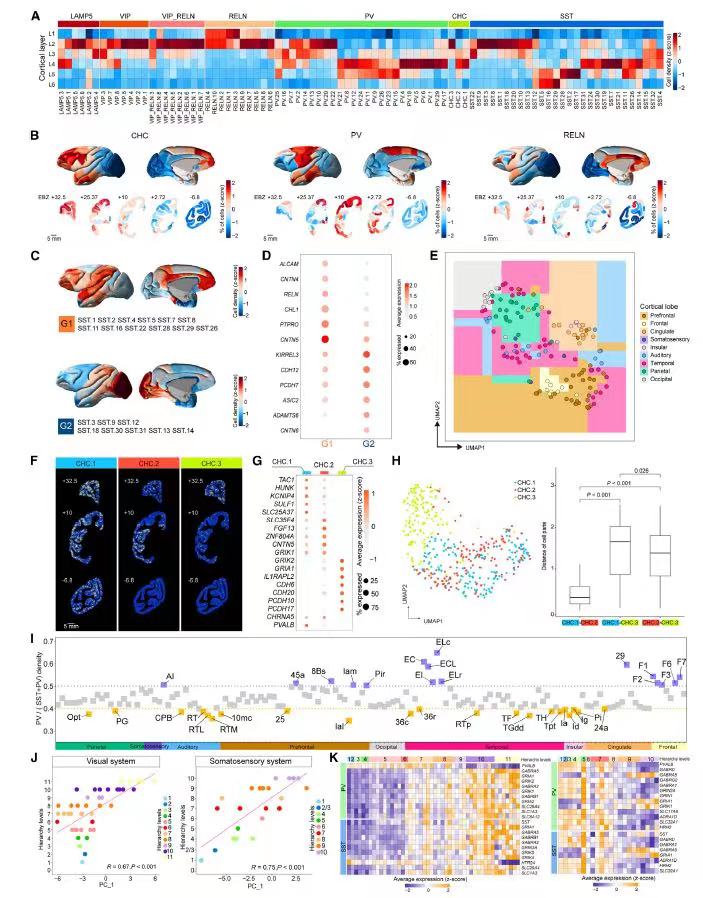
图6 猕猴皮质中GABAergic细胞类型的空间组织
6. 非神经元细胞的空间组织模式
通过snRNA-seq分析,研究主要鉴定了6种非神经员细胞(ASC、OLG、OPC、MG、EC 和 VMLC)。这些非神经元细胞的空间分布特点与中间神经元有一定相似,显示出跨皮质区域的层状定位模式(图7A)。研究人员对非神经元细胞类型的系统评估后,还发现了ASC、MG和OLG细胞类型沿A-P轴呈梯度分布的特点(图7E)。
在细胞类型的全局解析中,研究人员确定了两组分别定位在 L1和L6皮质层的ASC细胞类型,L6富集的ASC中出现较高水平的谷氨酸能受体基因表达(图7D),提示ASC类型对支持皮质功能的潜在贡献。对OLG的分析也获得了类似的发现,两种OLG细胞群分别沿A-P轴的内侧和后部区域集中分布(图6E)。值得注意的是,研究人员发现了一类在F1脑区存在明显富集的OLG.7 ANLN/MOBP细胞类型(图7G)。由于周围少突胶质细胞为其周围的神经元提供代谢支持,F1富集的OLG细胞类型可以满足该区域神经元冲动时更高的能量需求。综合表明,猕猴大脑皮质中这些非神经细胞类型具有脑区和皮质层中功能特异的特性。
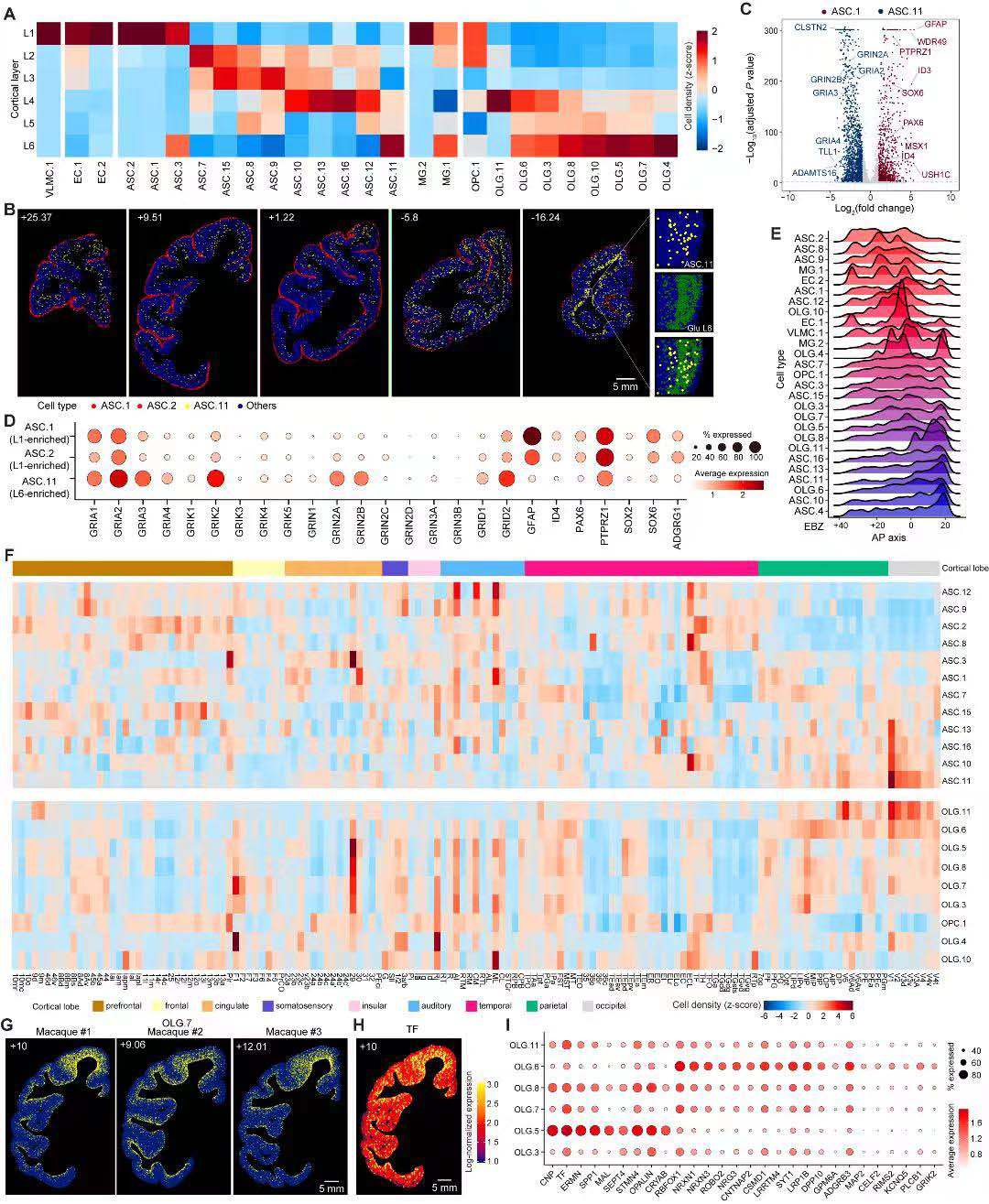
7. 跨物种比较分析揭示灵长类动物特异性细胞类型
研究人员为了探索灵长类动物发生皮质扩张的进化事件,将猕猴前额叶、运动皮质和视觉皮质的scRNA-seq数据与之前已发表的人类和小鼠皮质研究中检索到的数据进行系统比较。在谷氨酸能细胞簇中,发现人类和猕猴相比,小鼠在PFC、M1、V1皮质区域特有的一组谷氨能神经元,它们由6种L4亚型组成(图8A~8C)。这组灵长类特有的神经元高度表达一些人类疾病相关基因,包括FOXP2、EPHA3和DCC(图8G),且这些基因部分在空间上表现出区域依赖性的层状表达(图8H)。因此,研究人员推断,灵长类皮质的进化扩张伴随着L4皮质层灵长类特异性细胞类型的出现,还包括了FOXP2、EPHA3和DCC等基因的区域依赖性层状差异表达模式。
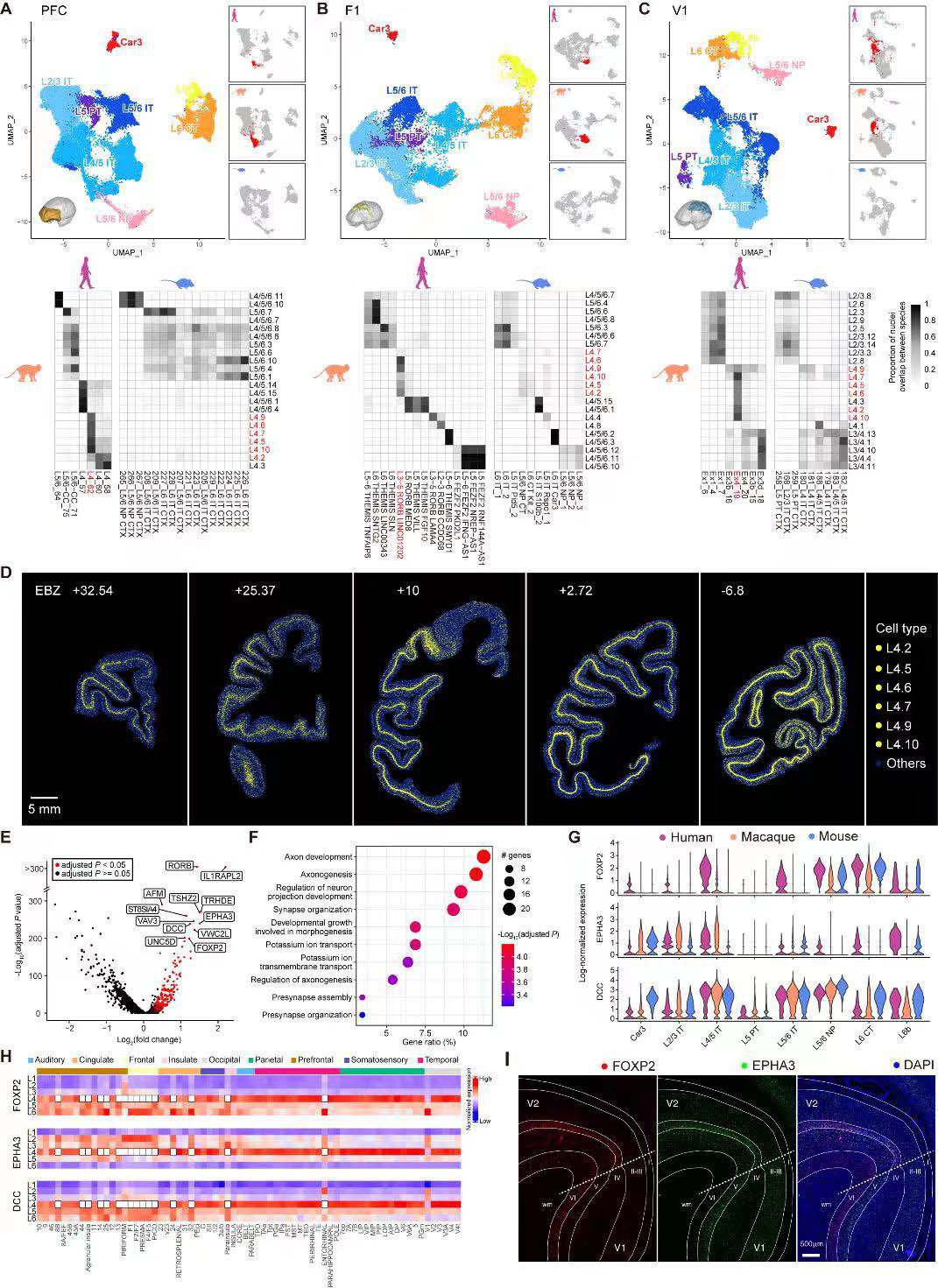
图8 猕猴、小鼠和人类三个皮质区域谷氨酸能神经元的比较
本研究中,研究人员联合Stereo-seq和snRNA seq,在单细胞水平上对整个猕猴的大脑皮质组织进行全面的空间转录组分析,系统表征了兴奋性神经元、抑制性神经元和非神经细胞亚型的分子指纹和空间组织模式。该研究使用数据的可重复性通过三只猴子在相似冠状坐标切片的基因表达谱和细胞组成映射中得到了证实。
本研究在谷氨酸能和GABAergic神经元内发现大量由转录组定义的细胞类型。研究人员特别发现了高度表达ADCYAP1的L2/3谷氨酸能神经元,由于ADCYAP1基因码驱动cAMP信号传导的肽,并充当神经系统中应激信号传导的“主调控因子”。先前根据激光捕获显微切割的结果表明,ADCYAP1在恒河猴dlPFC的L3锥体细胞中富集。因此,研究人员提出这种跨皮质区域且具有层特异性表达的基因需要进一步研究它在皮质中的作用。
本研究揭示了几个与皮质脑区层级结构相关的细胞组织规律。一是所有三种主要细胞类别都包含其脑区密度与感觉系统的皮质层级呈显著线性相关的细胞亚型;二是这些感觉系统间共享许多与层级结构呈显著线性相关的细胞类型;三是与层级结构负相关的谷氨酸能细胞亚型的数量远高于GABAergic细胞亚型;四是非神经细胞类型的区域分布仅与层级结构水平呈正相关。这些组织规律可能是随着层级结构信息处理复杂性不断增加的细胞基础,该研究结果为进一步研究不同细胞类型在不同层级皮质区域中的具体作用提供了良好基础。
考虑到前额叶、顶叶和颞叶皮质的新皮质扩张是灵长类进化中的重要一步,可能涉及灵长类特有的基因表达模式,而这些基因表达模式可能是形成复杂认知和行为功能的基础。研究人员通过跨物种比较分析,揭示了灵长类特异性的L4细胞类型高度表达神经精神风险基因FOXP2、肝配蛋白受体EPHA3和神经发育相关基因DCC。未来进一步比较人类、非人类灵长类动物和啮齿动物之间的空间转录组图谱,将为灵长类动物大脑的进化和形态发生提供分子见解。
综上,本研究提供了世界上首个在单细胞分辨率上全面的猕猴整个大脑皮质组织空间转录组图谱,并为未来大脑组织在进化、发育、衰老和发病机制过程中的分子和细胞研究,为后续相关研究提供了重要的数据资源库。
审核 | 雷莹、孙怡迪、Lina









