胃肠道就像一个生机勃勃的 “细菌王国”,形形色色的共生细菌在这里安居乐业。这些细菌在组织结构、免疫系统、昼夜节律、营养反应、能量与脂质代谢等诸多关键环节,都发挥着无可替代的关键作用。
无菌动物模型,尤其是小鼠,是深入探究微生物群对宿主生理影响的重要研究对象。通过这类模型,研究人员已初步揭示肠道微生物群调控多个器官发育与形态的机制。但对细胞、分子的空间排列、独特特征及协作机制等关键信息,缺乏足够的综合研究。因此,当前急需一种先进的技术工具,来深入探究细胞和分子的空间特征,解开微观生命的奥秘。
2025年2月14日,华大生命科学研究院方晓东、康美华大韩丽娟、哥本哈根大学Kristiansen Karsten、华中农业大学魏泓等在iMeta发表了肠道微生物相关研究。在本研究中,科研人员利用单细胞RNA测序技术(scRNA - seq)、华大自主研发的时空组学技术Stereo-seq,以及靶向胆汁酸代谢的组学手段,对无菌小鼠和无特定病原体小鼠的不同组织器官展开了全方位的多组学数据大对比。

该研究意在探究微生物群一旦“消失不见”,器官形态、细胞组成与功能、关键细胞因子的表达、胆汁酸肠肝轴的循环以及脂质代谢,究竟会怎样 “乱了节奏”,又怎样布局另外的生理“稳态系统”。总之,这次研究为探索微生物群与宿主之间千丝万缕的相互作用,提供了一份珍贵的 “参考地图”,助力研究人员在这片神秘领域大步前行。
该研究对比了无菌(Germ-Free,GF)小鼠和无特定病原体(Specific Pathogen-Free,SPF)小鼠在微生物群缺失情况下的多组学数据,探讨了其对免疫系统、脂质稳态、器官发育和细胞功能的影响。通过喂养相同低粗纤维饲料,研究者发现GF小鼠在免疫细胞、脂蛋白水平和生理表型等方面存在异常,且小肠、盲肠、肝脏和脾脏等器官形态发生显著变化,提示微生物群对器官结构和免疫微环境有重要影响。进一步的scRNA - seq识别了17个主要细胞群体,并发现GF小鼠在各组织中免疫细胞的丰度存在显著差异。
基于上述发现,研究者借助Stereo-seq数据,运用广度优先搜索(BFS)算法定义了空间聚集指数。经过对聚集特征的量化和统计分析,研究人员有了奇妙发现:在SPF小鼠的不同器官里,浆细胞就像有组织的小团体,呈现出显著的区域聚集特性。在肠道这个 “大通道” 里,浆细胞都扎堆在肠固有层这个 “热闹街区”;而在肝脏这个 “化工厂” 中,它们则主要聚集在门静脉周围,仿佛这里是它们的 “秘密基地”。反观GF小鼠,情况截然不同。它的肝脏、脾脏和肠道里,浆细胞的占比大幅下降,而且,GF小鼠结肠内浆细胞的簇群数量和聚集规模,都比SPF小鼠小得多,显得冷冷清清。不过,胸腺这个相对偏远的初级淋巴器官,浆细胞比例变化不大,就像一个不太受外界影响的 “世外桃源”。
以上结果清晰地表明,微生物群对肝脏、脾脏和肠道里的浆细胞影响显著,而对胸腺的影响则小得多,这和之前其他研究者的结论不谋而合。借助Stereo-seq量化的空间聚集指数,研究人员还发现,GF小鼠脾脏中边缘巨噬细胞区的连通性糟糕,就像城市里道路不通畅,这意味着微生物缺失可能让脾脏这个 “小天地” 的结构变得混乱,或者阻碍了它正常发育成熟。
为了进一步揭开微生物缺失后肝脏免疫细胞的空间分布变化之谜,研究人员依据肝脏Stereo-seq数据(Bin20),像拆解精密仪器一样,将肝小叶结构细致划分为 9 个层次(Layer)。统计分析后发现,在SPF小鼠中,Kupffer 细胞从Layer1(中央静脉)到Layer9(门静脉),就像一群朝着特定方向迁徙的 “小生物”,呈现出显著的富集趋势。然而,当微生物缺失后,GF小鼠里这种富集现象就像被泼了冷水,大大减弱。总体而言,微生物群在免疫细胞成熟、器官结构发育和肠上皮功能维持这些重要生命进程中,扮演着无可替代的关键角色,就像一场精彩演出中不可或缺的灵魂人物。
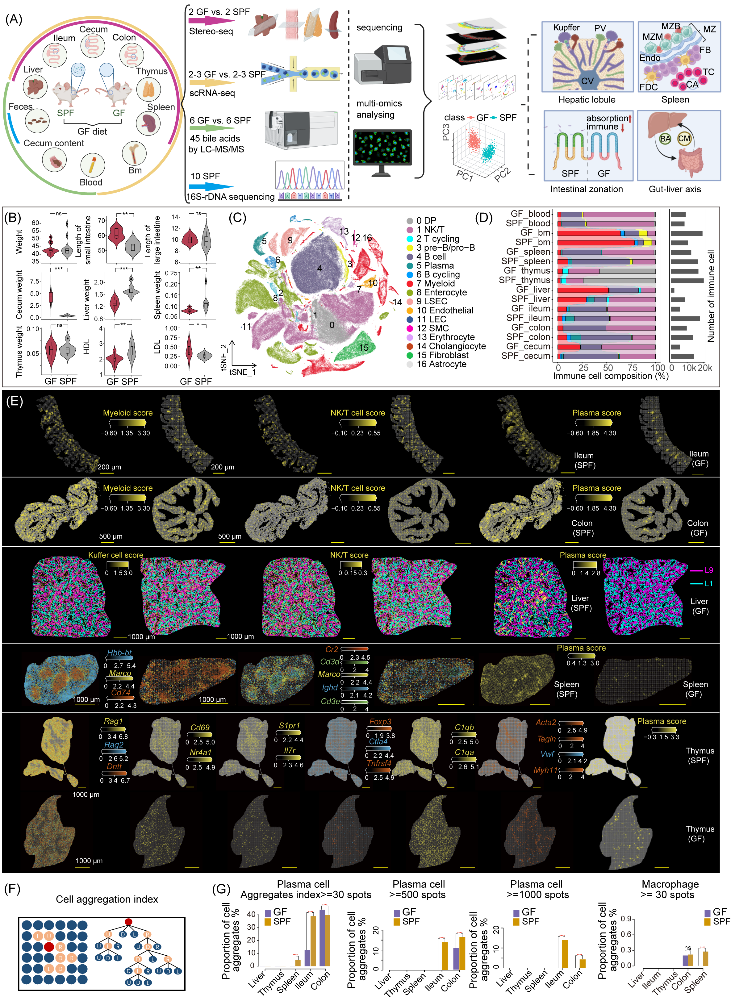
图1. 多组学研究设计及单细胞和时空组学数据概览
02. 微生物群在B细胞发育和浆细胞组成的调节中表现出器官异质性
通过scRNA-seq和Stereo-seq数据分析,研究者发现微生物缺失后,GF小鼠脾脏中的B细胞总数显著减少,脾脏边缘区(MZ)B细胞、滤泡(FC)B细胞的细胞周期受到扰动,GF小鼠的MZ B细胞具有更多差异及特异表达基因,其上调的基因主要涉及淋巴细胞激活、B细胞增殖分化和适应性免疫等方面,表明GF小鼠MZ B细胞发育异常。
进一步研究发现,GF小鼠中Cr2基因在脾脏MZ B细胞、FC B细胞以及其他组织的成熟B细胞中均呈现上调表达。这一结果与先前报道的微生物通过Cr2基因调控MZ B细胞命运的研究成果相吻合。在肠道中,GF小鼠激活型B细胞比例下降,未激活型B细胞比例增加,进一步表明微生物群在B细胞发育中的重要作用。
浆细胞亚型分析发现,IgA浆细胞在SPF小鼠中占主导地位,主要分布于血液、肝脏和肠道。IgG浆细胞主要位于肝脏和脾脏,而IgM浆细胞则主要分布于脾脏。在微生物缺失的GF小鼠中,IgA浆细胞比例显著下降,而IgM浆细胞比例基本保持不变,这一结果与已有研究一致,表明IgA的产生依赖于微生物群,而IgM的产生则相对独立于微生物群。
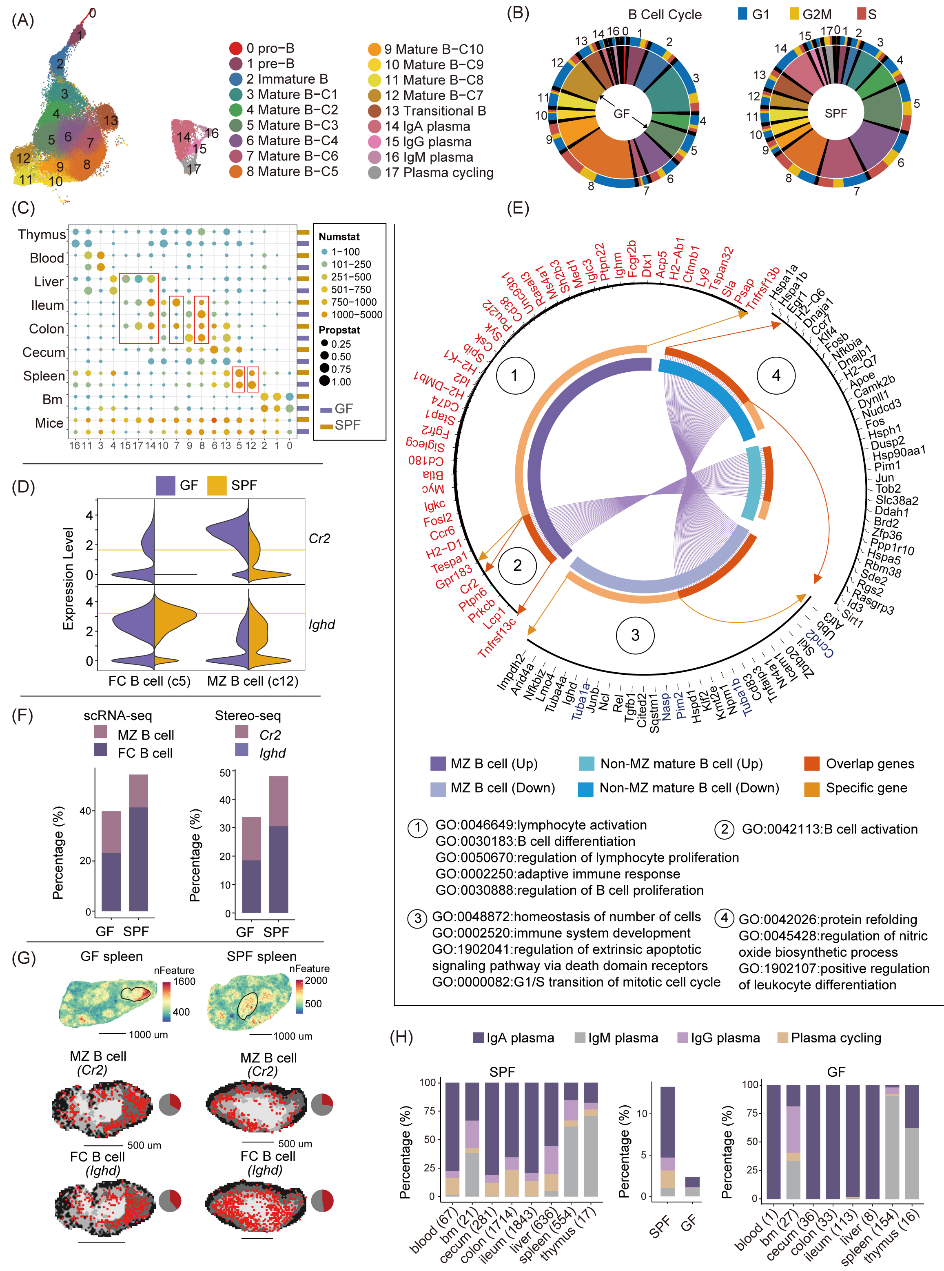
图2. 微生物群调节的B细胞组分在各组织中的异质性
03. 微生物群在调节髓系细胞功能及T细胞发育与成熟方面表现出器官异质性
在髓系细胞领域,GF小鼠大肠内高表达Retnla巨噬细胞呈现出功能重塑与分布异常的现象。与正常的SPF小鼠相比,GF小鼠的这类巨噬细胞不再将抗原呈递及淋巴细胞激活等调节功能作为主要功能,而是在功能上发生了显著偏移,转而深度参与到维持盲肠异常肿大状态下的生理稳态进程中,同时其在盲肠中的占比也大幅攀升。
此外,微生物的缺失还对GF小鼠骨髓中性粒细胞的生存状况产生负面影响,致使其存活率下降,最终导致外周中性粒细胞数量显著减少。然而,骨髓中性粒细胞的比例却保持不变,分子层面的相关机制调节有待进一步挖掘。在NK/T细胞层面,微生物缺失导致GF小鼠胸腺内T祖细胞的细胞周期和发育显著异常。同时外周器官Naive T细胞数量增多,效应T细胞亚群显著减少。
与此同时,GF小鼠肠上皮内T细胞的亚型比例也出现了明显的改变,其中天然型具备细胞毒性特征的CD8αα_1细胞在回肠中的占比急剧增加,有意思的是该细胞除了发挥细胞毒性功能外,其脂类吸收转运相关功能显著增强。
这些结果清晰地揭示出肠道菌群在免疫系统走向成熟以及维持免疫稳态方面的核心地位与关键作用。细胞因子表达同样受到微生物群缺失的强烈冲击。在GF小鼠体内,多种细胞类型的调节因子表达出现异常波动。像B细胞/浆细胞中的抗菌基因、Th17细胞中的Il17a和Il22等调节因子显著下调,然而,部分抗菌基因和趋化因子却在特定细胞类型中反常地上调。这些结果表明,微生物群缺失对免疫细胞的发育、功能和细胞因子表达产生广泛影响,进而影响免疫系统的稳态和免疫功能。
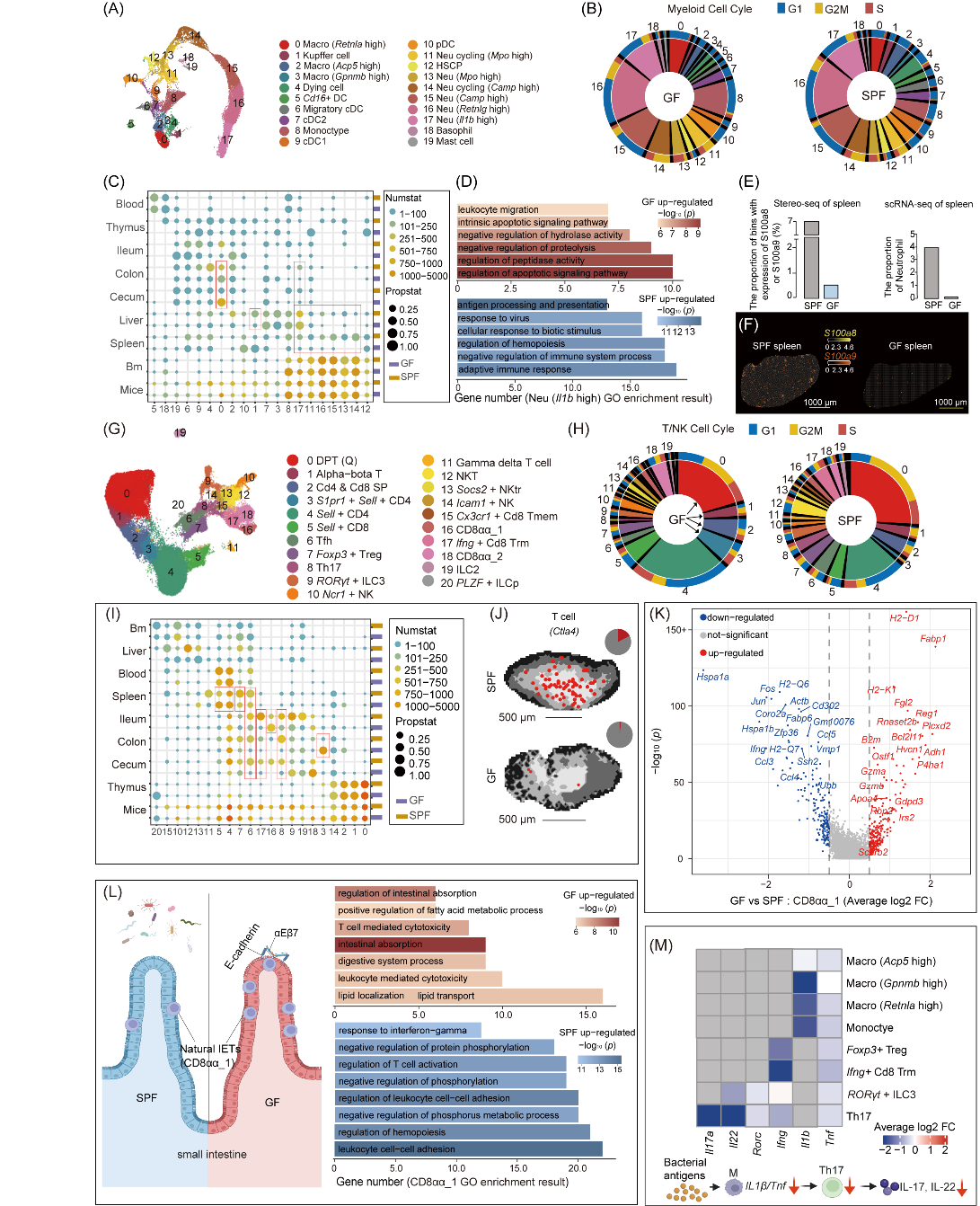
图3. 微生物群调节的髓系和NK/T细胞亚型在各组织中的异质性
当肠道微生物缺失,在GF小鼠的肠道这片 “工作场地” 上,一场别样的 “调整” 静悄悄地展开。时空组学技术Stereo-seq宛如一位无畏的探险家,在窥探肠道过程中收获了有趣的发现!原本负责各项工作的 “细胞员工们”,面临着工作任务的巨大变动。肠道上皮细胞里,负责顶端营养吸收的部分,如同得知将有大量任务袭来,正全力储备能量的工作团队,积极 “加餐”,努力壮大自身,占据的“空间地盘”越来越多,仿佛在为即将到来的忙碌工作做足准备。而结肠分泌区的细胞,却仿佛收到了业务量减少的通知,如同被施了 “缩水魔法”, “空间地盘”越来越少。
这一多一少的显著变化,清晰地表明肠道微生物缺失后,肠道的 “工作重心” 发生了转移。这一转变有力地彰显出肠道上皮在脂质吸收和代谢这场关乎生命运转的 “宏大剧目” 里,扮演着极为关键的角色,其工作分配的调整,深刻影响着肠道的整体功能运作。
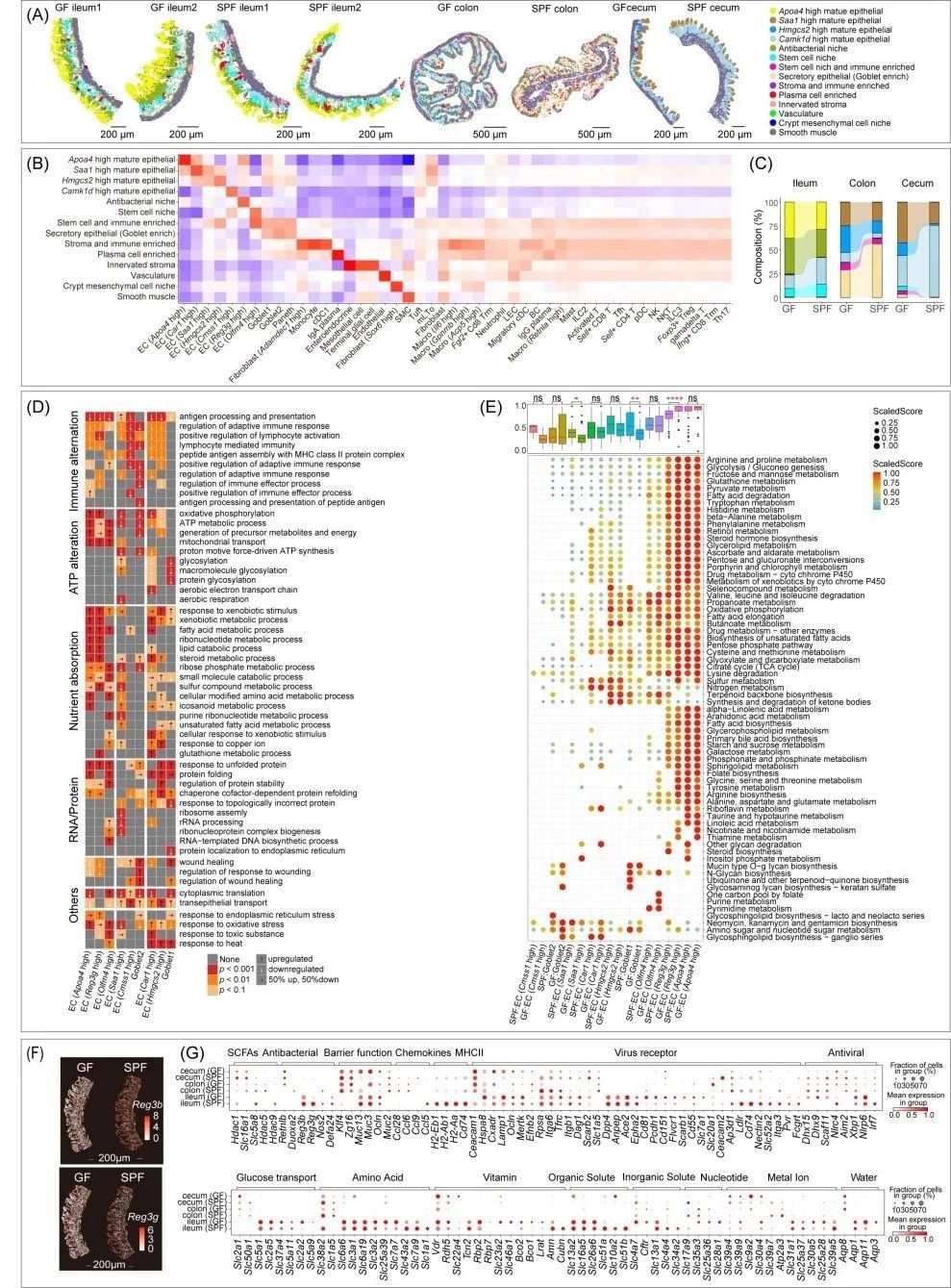
图4. 微生物群缺失导致肠上皮功能和分区的变化
05. 微生物群通过ZBTB20-LPL轴在肝脏调控膳食脂质代谢与血脂水平
肠道黏膜上皮细胞里的差异表达基因,仿佛是一个个神秘的 “小信使”,它们传递的信息竟然和人类的血脂、BMI等生理特征紧密相连,就像有着一根无形的线,将小鼠和人类的这些关键生理指标紧紧牵在一起。针对脂代谢这些核心问题,研究者精心地绘制出一幅详细的分子路线图。在这幅图里,脂肪酸吸收、甘油三酯合成、乳糜微粒组装、高尔基体转运、脂滴形成、脂解和脂噬,以及脂肪酸线粒体氧化等脂类变化的过程,就像一条热闹非凡的 “分子高速公路”,各个环节清晰呈现。
通过对比,研究人员发现,GF小鼠有着独特的脂滴特征,就像是给自己的脂肪 “小仓库” 贴上了专属标签。而且,它们还拥有一条独特的脂滴分解 “秘密通道”—脂噬途径。不仅如此,GF小鼠体内的脂肪酸氧化过程,更是如同身体里火力全开的 “脂肪燃烧器”,协助消除脂肪堆积。毫无疑问,这些奇妙的过程都在齐心协力,在GF小鼠抵抗肥胖的艰难征程中,发挥着至关重要的作用。
为了弄清楚肠道脂质代谢变化会如何影响肝脏,研究者借助Stereo-seq深入肝脏不同区域,分析差异基因表达。这一探索发现,那些差异基因也像一群 “扎堆爱好者”,主要聚集在脂质合成、运输、维持稳态等 “热闹通路”。值得一提的是,Stereo-seq精准探测到,脂蛋白脂肪酶(Lpl)表达在肝小叶的中央静脉呈现高富集的趋势,在微生物缺失后,Lpl像挣脱了缰绳的小马驹,表达量蹭蹭上涨,空间分布也开始随机化。而GF小鼠这一表达的提升增强了血液VLDL向LDL的转换,然而,由于肝脏里低密度脂蛋白受体(LDLR)的表达减少,导致肝脏对LDL的 “回收大业” 困难重重。这一升一降,使得血液里的LDL越来越多,可能是GF小鼠血液中低密度脂蛋白水平异常的原因之一。
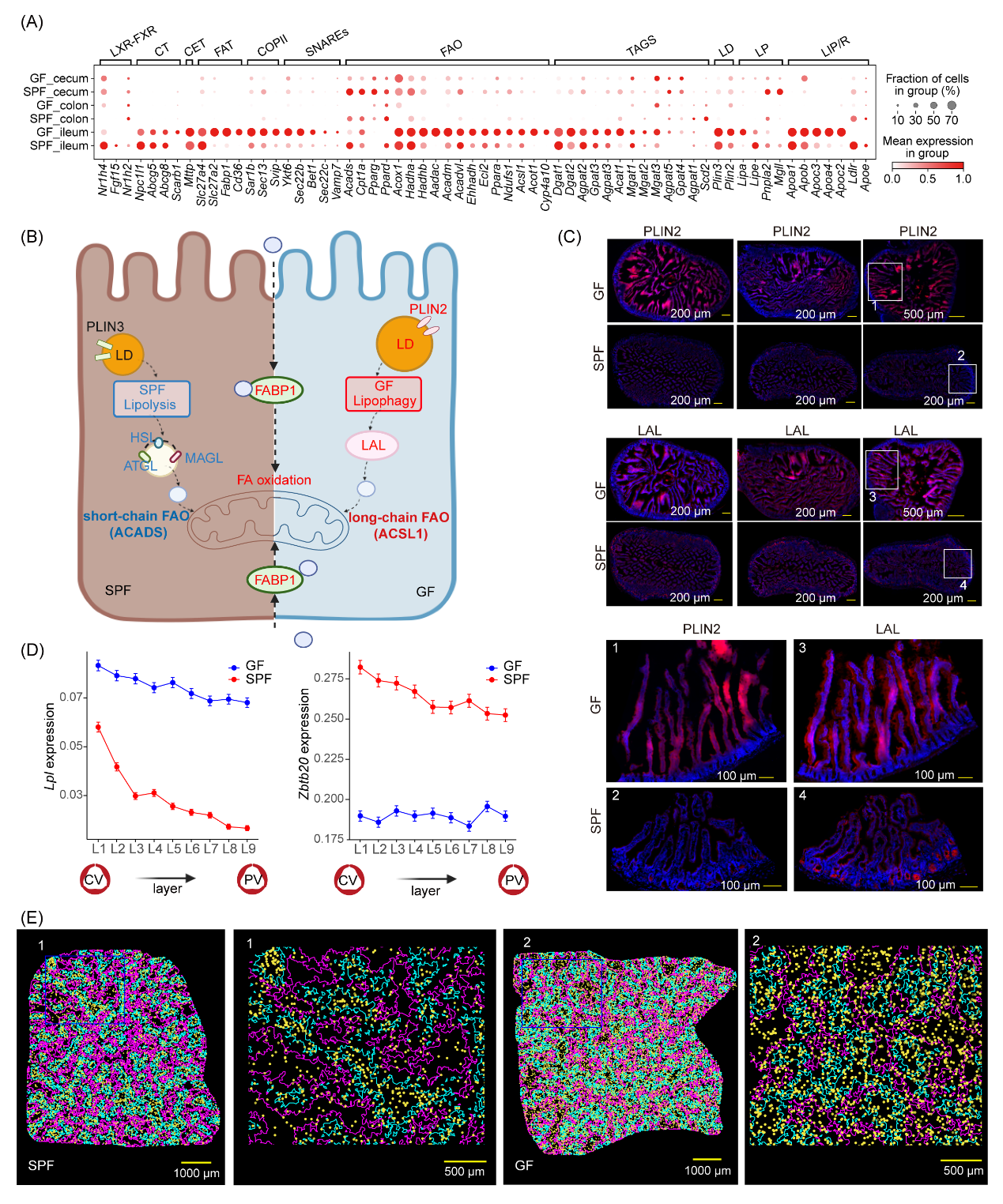
图5.微生物缺失后,肠上皮细胞和肝脏中血脂调节轴(ZBTB20-LPL)的空间分区特征及脂质吸收和代谢景观变化
06. 整合分析揭示微生物群的缺失改变了胆汁酸的合成途径和重吸收能力
肠道微生物群堪称胆汁酸代谢这场 “生命大戏” 里的关键 “主角”,它直接左右胆汁酸的 “组成阵容”。为研究微生物缺失的影响,研究者细致分析了胆汁酸水平及类型。结果显示,GF小鼠在多个器官及体液中胆汁酸水平下降,而且,GF小鼠肝脏中的胆汁酸类型也和SPF小鼠不同,GF小鼠肝脏里主要是游离的初级胆汁酸,像 “散兵游勇”;SPF小鼠肝脏则以结合型胆汁酸为主,好似 “团结的战队”。值得注意的是,GF小鼠肝脏内CDCA/CA、β-MCA/CA 的比例显著上升。这显示微生物群缺失,致使胆汁酸合成途径从经典 “赛道” 转向了替代路线 。
肠道菌群缺失,影响的可不只是胆汁酸产生,还通过和关键重吸收转运蛋白 “打交道”,调控胆汁酸的肝-肠循环。有趣的是,Stereo-seq、scRNA-seq 数据以及HE染色就像三位神奇的 “微观探险家”,一同证实了在GF小鼠的肝脏这个 “小世界” 里,胆管细胞的比例如同雨后春笋般增加了。这一奇妙发现,与此前GF小鼠血管化面积增大的研究成果高度契合。至于无菌小鼠胆管和胆汁酸之间究竟有怎样的紧密联系,有待科学家们进一步去 “解锁”。
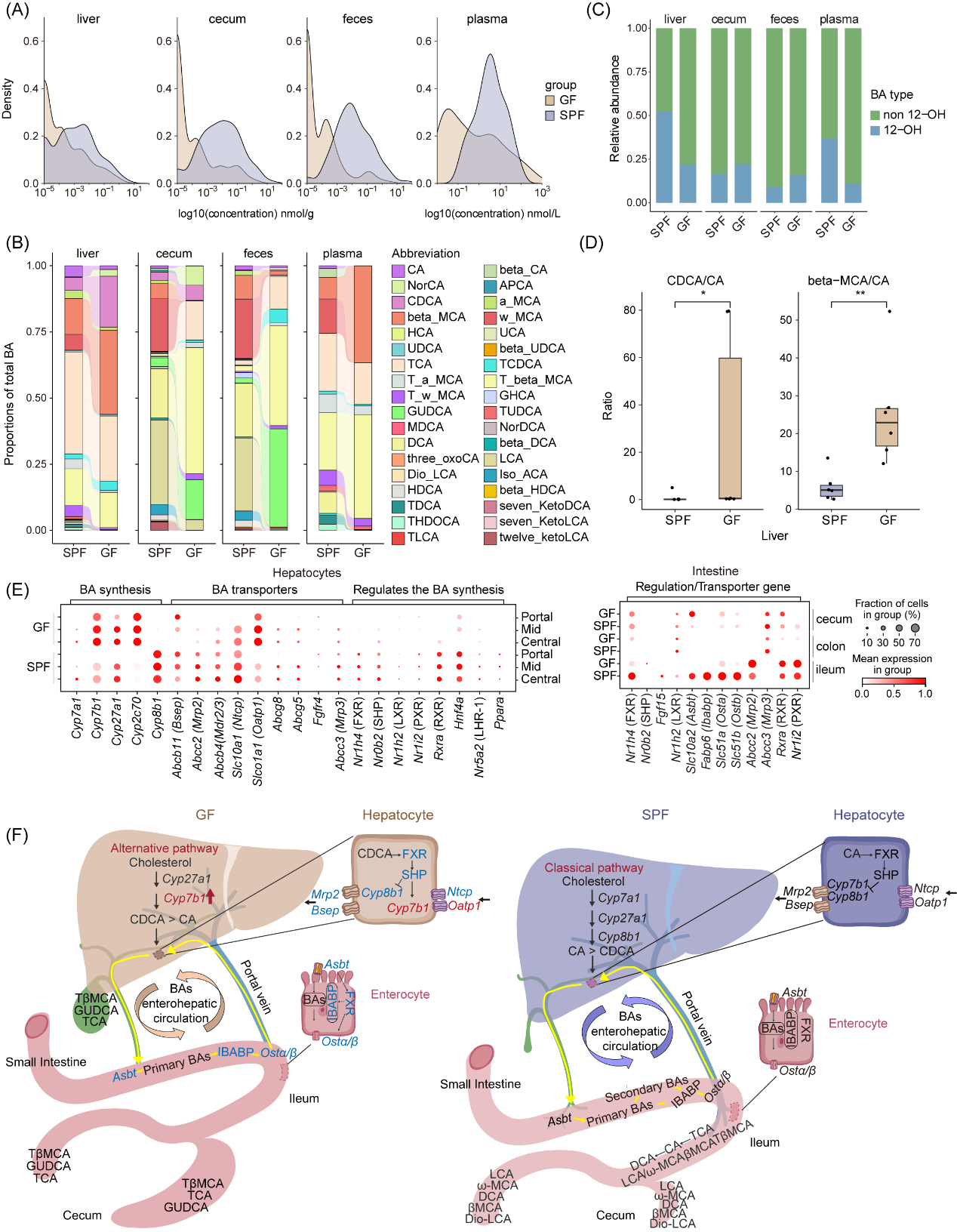
图6. 微生物群缺失改变胆汁酸合成途径和再吸收能力
该研究对比了GF(无菌)和SPF(特定病理无菌)小鼠,通过深入的多器官单细胞、空间转录组学和胆汁酸代谢组学分析,揭示了微生物缺失对小鼠免疫系统和脂质代谢的深远影响。研究发现,微生物缺失显著改变了免疫细胞的发育和功能,导致B细胞、T细胞、髓系细胞及中性粒细胞的异常,以及免疫应答能力的减弱和适应性免疫细胞比例的下降。
同时,GF小鼠的胆汁酸代谢途径发生转变,胆汁酸转运蛋白表达降低,进一步影响胆汁酸的吸收、回收与分布。在脂质代谢方面,回肠中脂肪酸吸收和脂滴形成相关基因表达增强,而肝脏中脂肪生成与氧化基因表达减少,显示出GF小鼠独特的脂质代谢调控机制。空间转录组学分析首次揭示了GF小鼠肠道粘膜功能分区的显著变化,小肠吸收性肠细胞中脂滴扩大、脂肪自噬增强及脂肪酸氧化增加,这可能是GF小鼠抵抗肥胖的关键机制。
此外,肝脏空间转录组学分析还首次发现ZBTB20-LPL轴存在梯度表达模式,该轴调控血脂水平并受微生物群调节。这些发现不仅为理解宿主与微生物群的复杂相互作用提供了宝贵资源,也为未来探索微生物在免疫与代谢调控中的作用奠定了坚实基础。
华大生命科学研究院沈娟、梁伟明、赵瑞珍,广东省中医院陈洋,广州中医药大学第二附属医院刘艳敏,华中农业大学动物科学技术学院程伟为文章共同第一作者,华大生命科学研究院方晓东,康美华大韩丽娟,哥本哈根大学Kristiansen Karsten,华中农业大学魏泓为文章共同通讯作者。
以上研究中使用到的时空产品方案为适用于新鲜冷冻样本的时空转录组FF。目前该方案已升级为时空转录组FF V1.3,升级后其在保持Stereo-seq技术“纳米级分辨率”和“厘米级全景视场”的两大优势下,通过优化时空试剂、酶、探针设计以及算法软件,捕获效率大幅提升,工作流程更快速简便,用户友好性显著增强,可助力研究人员轻松获得每个细胞内的更多高质量转录本数据,为各种应用场景下的科学研究提供无与伦比的洞察力。









